题目内容
1.某化学兴趣小组为测定某石灰石样品中碳酸钙的质量分数,取12.5g石灰石样品放在烧杯中,然后向其中逐渐加入稀盐酸,使之与样品充分反应,恰好完全反应(杂质不参加反应)时,加入稀盐酸的质量为146g,反应后烧杯中物质的总质量为154.1g.请计算:(1)反应生成二氧化碳的质量.
(2)样品中碳酸钙的质量分数(纯度).
分析 分析所发生的反应,可发现反应后总质量减轻是由于生成了气体二氧化碳,根据质量守恒定律可求出二氧化碳的质量.然后利用二氧化碳的质量,根据反应的化学方程式,计算恰好完全反应时碳酸钙的质量,最后使用质量分数的计算公式,求出样品中碳酸钙的质量分数.
解答 解:生成二氧化碳的质量为:12.5g+146g-154.1g=4.4g;
设样品中CaCO3的质量为x,
CaCO3+2HCl═CaCl2+H2O+CO2↑
100 44
x 4.4g
$\frac{100}{x}$=$\frac{44}{4.4g}$
x=10g
样品中碳酸钙的质量分数是:$\frac{10g}{12.5g}$×100%=80%.
答:(1)反应生成二氧化碳质量为2.2g;
(2)样品中碳酸钙的质量分数为80%.
点评 根据反应的化学方程式能表示反应中各物质的质量关系,由反应中某物质的质量可计算出反应中其它物质的质量.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
9.下列都是与生活相关的物质,其中属于纯净物的是( )
| A. | 铝合金门窗 | B. | 新鲜牛奶 | C. | 医用酒精 | D. | 体温计中的水银 |
16.20℃时,在三个各盛有100g水的容器中分别加入甲、乙、丙三种纯净物(不含结晶水,不与水反应)各10g,充分溶解后,情况如下表所示,有关说法不正确的是( )
| 物 质 | 甲 | 乙 | 丙 |
| 未溶解固体的质量/g | 7 | 0 | 3 |
| A. | 升高温度,三溶液中溶质的质量分数一定会改变 | |
| B. | 三溶液中溶质的质量分数乙>丙>甲 | |
| C. | 所得溶液可能都是饱和溶液 | |
| D. | 20℃时,甲的溶解能力最小 |
6.下列净水操作中,对水的净化程度最高的是( )
| A. | 蒸馏 | B. | 煮沸 | C. | 消毒 | D. | 沉淀 |
11.通过对溶液知识的学习,判断下列有关说法中正确的是( )
| A. | 溶液的溶质可以是一种或几种 | |
| B. | 溶液一定是无色.澄清.透明的 | |
| C. | 浓溶液一定是饱和溶液 | |
| D. | 饱和溶液析出晶体后溶质质量分数一定增大 |


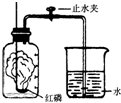 某同学设计了测定空气中氧气含量的实验,实验装置如图.该同学的实验步骤如下:
某同学设计了测定空气中氧气含量的实验,实验装置如图.该同学的实验步骤如下: