题目内容
市售过碳酸钠(Na2CO4)中往往含有少量杂质碳酸钠,化学兴趣小组同学购得一包市售过碳酸钠样品,欲测定样品中过碳酸钠的质量分数:
【阅读资料】
①过碳酸钠和盐酸反应的化学方程式为2Na2CO4+4HCl=4NaCl+2CO2↑+O2↑+2H2O
②常温常压下,氧气的密度为1.429g/L
③过碳酸钠通常用作洗衣粉的助剂,可以去除多种顽固污渍,同时清除细菌和异味。
【讨论探究】
甲同学认为可以通过测定反应生成的二氧化碳的体积,求得样品中过碳酸钠的质量分数;乙同学认为可以通过测定反应生成的氧气的体积,求得样品中过碳酸钠的质量分数。兴趣小组经过讨论后,认为甲同学的方案不合理。请你写出可能的原因 ________
_____________________________________________________________________________。
【定量测定】
同学们根据乙同学的实验方案,设计了实验装置(如下图所示),取8.0 g样品投入烧瓶中,逐滴滴加盐酸直至不再产生气泡为止。

(1)装置B的作用是_______________________________________________。
(2)装置C的作用是_______________________________________________。
(3)通过排水量测定氧气的体积为672.0 mL,请计算样品中过碳酸钠的质量分数是多少?
(最后得数保留小数点后一位)
【定性实验】
同学们将过碳酸钠溶于热水中,将得到的溶液分成两份,往其中一份溶液加入MnO2,迅速冒出大量气泡,将带火星的木条伸入,木条复燃;另一份溶液等其不再产生气泡后,加入氯化钙溶液,产生白色沉淀。你推测过碳酸钠溶于水可能生成的物质是_____________
______________________。
【知识拓展】根据实验,你认为过碳酸钠应该如何保存___________________________。
【讨论探究】过碳酸钠与盐酸反应能生成二氧化碳,杂质碳酸钠与盐酸反应也能生成二氧化碳,所以通过测定二氧化碳体积求算过碳酸钠质量不准确。(2分)(其他合理答案均可)
【定量测定】(1)除去二氧化碳、氯化氢气体等 (2)检验二氧化碳是否除尽
(3)(5分)解:设过碳酸钠的质量为x
2Na2CO4+4HCl=4NaCl+2CO2↑+O2↑+2H2O
2×122 32 (1分)
X 0.672 L ×1.429g/L
×1.429g/L
 (1分)
(1分)
X=7.3 g (1分)

 (2分)
(2分)
答:样品中过碳酸钠的质量分数是91.5%
【定性实验】 H2O2 Na2CO3 (各1分)
【知识拓展】放置在干燥处

 B.2Al+3H2SO4=Al2(SO4)3+3H2↑
B.2Al+3H2SO4=Al2(SO4)3+3H2↑
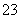 )+c(HCO
)+c(HCO )+c(H2CO3)
)+c(H2CO3)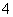 )>c(H+)>c(OH-)
)>c(H+)>c(OH-)