题目内容
5.用化学符号填空:(1)2个氢原子2H;
(2)地壳中含量最高的金属元素Al;
(3)食盐水中的溶剂H2O;
(4)二氧化碳分子CO2.
(5)太阳镜具有保护眼睛的功能.它的镜脚一般是由塑料(其中含有碳元素C)制成的,玻璃镜片的主要成分是二氧化硅SiO2,且变色玻璃中含有银离子Ag+,铜制镜框使用时间过长会生成铜绿[Cu2(OH)2CO3],铜绿中氢氧根的化合价显-1价Cu2($\stackrel{-1}{OH}$)2CO3.
分析 (1)原子的表示方法,用元素符号来表示一个原子,表示多个该原子,就在其元素符号前加上相应的数字.
(2)地壳中含量最高的金属元素是铝元素.
(3)食盐水中的溶剂是水.
(4)分子的表示方法,正确书写物质的化学式,表示多个该分子,就在其化学式前加上相应的数字.
(5)书写元素符号时应注意:①有一个字母表示的元素符号要大写;②由两个字母表示的元素符号,第一个字母大写,第二个字母小写.
化合物化学式的书写一般规律:金属在前,非金属在后;氧化物中氧在后,原子个数不能漏,正负化合价代数和为零.
离子的表示方法,在表示该离子的元素符号右上角,标出该离子所带的正负电荷数,数字在前,正负符号在后,带1个电荷时,1要省略.
由化合价的表示方法,在其化学式该元素的上方用正负号和数字表示,正负号在前,数字在后.
解答 解:(1)由原子的表示方法,用元素符号来表示一个原子,表示多个该原子,就在其元素符号前加上相应的数字,故2个氢原子可表示为:2H.
(2)地壳中含量最高的金属元素是铝元素,其元素符号为Al.
(3)食盐水中的溶剂是水,其化学式为:H2O.
(4)由分子的表示方法,正确书写物质的化学式,表示多个该分子,就在其化学式前加上相应的数字,则二氧化碳分子可表示为:CO2.
(5)碳元素的元素符号为:C.
二氧化硅的化学式为:SiO2.
离子的表示方法,在表示该离子的元素符号右上角,标出该离子所带的正负电荷数,数字在前,正负符号在后,带1个电荷时,1要省略.银离子可表示为:Ag+.
由化合价的表示方法,在其化学式该元素的上方用正负号和数字表示,正负号在前,数字在后,故铜绿中氢氧根的化合价显-1价可表示为:Cu2($\stackrel{-1}{OH}$)2CO3.
故答案为:(1)2H;(2)Al;(3)H2O;(4)CO2;(5)C;SiO2;Ag+;Cu2($\stackrel{-1}{OH}$)2CO3.
点评 本题难度不大,掌握常见化学用语(元素符号、原子符号、分子符号、化学式、化合价、离子符号等)的书写方法、离子符号与化合价表示方法的区别等是正确解答此类题的关键.

| A. | 红纸剪成窗花 | B. | 火药爆炸 | C. | 冰块制成冰雕 | D. | 湿衣服晾干 |
 符合图中阴影部分的化学反应的文字表达式是( )
符合图中阴影部分的化学反应的文字表达式是( )| A. | 石蜡+氧气$\stackrel{点燃}{→}$水+二氧化碳 | |
| B. | 铁+氧气$\stackrel{点燃}{→}$四氧化三铁 | |
| C. | 高锰酸钾$\stackrel{加热}{→}$锰酸钾+二氧化锰+氧气 | |
| D. | 氢气+氧化铜$\stackrel{加热}{→}$铜+水 |
| A. | 老酒的主要成分是酒精和水,有一定的颜色,是乳浊液 | |
| B. | 老酒选用优质糯米发酵而成,发酵要利用酵母菌的无氧呼吸,是有性生殖 | |
| C. | 老酒在贮存过程中,乙醇等物质挥发,酒精度下降,是利用了乙醇的化学性质 | |
| D. | 老酒越陈越醇,在老酒的陈化过程中,生成了一种有香味的酯,是化学变化 |
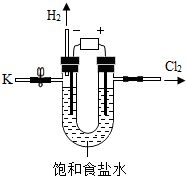 某学习小组对课本中“食盐常用于制氯气、烧碱”的内容产生兴趣.在老师的指导下,用自制的实验装置(主体部分如右图所示)进行电解饱和食盐水制取氢氧化钠的实验.一段时间后,关闭电源,从K处导出部分的溶液作为待测液进行如下探究.
某学习小组对课本中“食盐常用于制氯气、烧碱”的内容产生兴趣.在老师的指导下,用自制的实验装置(主体部分如右图所示)进行电解饱和食盐水制取氢氧化钠的实验.一段时间后,关闭电源,从K处导出部分的溶液作为待测液进行如下探究.老师提示:I.电解饱和食盐水化学方程式:
2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+H2↑+Cl2↑
II.忽略其他可能发生的反应对以下实验的影响.
探究活动一:检验待测液中含有氢氧化钠
(1)同学们选用某种酸碱指示剂对待测液进行检验,请你将实验报告填写完整.
| 实验步骤 | 实验现象 | 实验结论 |
| 取样,滴加几滴无色酚酞试液 | 溶液变红色 | 待测液呈碱性,表明含有氢氧化钠 |
【实验1】用酸碱中和法测定
甲组同学称取一定质量的待测液于烧杯中,加水稀释,用带有刻度的滴管逐滴加入一定溶质质量分数的稀盐酸,边加边振荡,用pH计测定溶液的pH,所得数据
如下:
| 加入稀盐酸的体积/mL | 0 | 2.0 | 4.0 | 6.0 | 8.0 | 9.8 |
| 烧杯中溶液的pH | 13.0 | 12.9 | 12.8 | 12.6 | 12.3 | 7.0 |
【实验2】用沉淀法测定
资料摘要:氢氧化钠与氯化镁溶液中发生反应:2NaOH+MgCl2=Mg(OH)2↓+2NaCl
乙组同学按下图所示的实验步骤进行实验:
①取待测液称重②加入足量氯化镁溶液③过滤出沉淀物④洗涤沉淀物⑤干燥称重
(3)步骤②加入的氯化镁溶液必需足量,其目的是使NaOH完全反应.滴加一定量氯化镁溶液后,判断所加氯化镁溶液是否足量的具体操作:静置,往上层澄清液体继续滴加氯化镁溶液,若无白色沉淀生成,说明所加氯化镁溶液已足量(写出实验步骤、现象和结论).
(4)步骤③过滤出的沉淀物是Mg(OH)2.
(5)利用沉淀物的质量计算氢氧化钠的质量分数,若缺少步骤④的操作,所测定氢氧化钠的质量分数将偏大(选填“偏大”、“偏小”或“没影响”).
| 物质 | 甲 | 乙 | 丙 | 丁 |
| 反应前的质量/g | 10 | 10 | 10 | 2 |
| 反应后的质量/g | 待测 | 2 | 21 | 2 |
| A. | 该反应一定是化合反应 | |
| B. | 丁可能是催化剂 | |
| C. | 该反应中乙、丙两物质的质量比是2:21 | |
| D. | 待测值甲的质量是7g |
| A. |  腐蚀性 | B. |  爆炸性 | C. |  剧毒性 | D. |  易燃性 |