题目内容
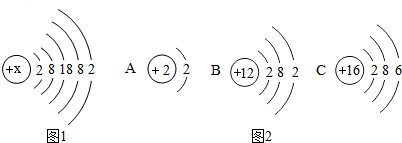
5.已知锶元素的符号为Sr,锶的原子结构示意图如图1所示,问:(1)锶原子核电荷数为38,锶元素位于第5周期.
(2)锶元素的化学性质与图2中B(填序号)元素的化学性质最相似,它们在化学反应过程中,易失去(填“失去”或“得到”)电子形成离子,形成的锶离子符号为Sr2+.
分析 (1)原子结构示意图中,圆圈内数字表示核内质子数(即核电荷数),当质子数=核外电子数,为原子;周期数=原子核外电子层数,进行分析解答.
(2)根据元素的化学性质跟它的原子的最外层电子数目关系非常密切,最外层电子数相同的元素化学性质相似,据此进行分析解答.
原子结构示意图中,弧线上的数字表示该层上的电子数,离圆圈最远的弧线表示最外层.若最外层电子数≥4,在化学反应中易得电子,若最外层电子数<4,在化学反应中易失去电子.
解答 解:(1)由锶的原子结构示意图,当质子数=核外电子数,为原子,锶原子核电荷数为2+8+18+8+2=38;周期数=原子核外电子层数,锶原子的核外有5个电子层,则锶元素位于第5周期.
(2)决定元素化学性质的是最外层电子数,原子的最外层电子数相同,具有相似的化学性质;由锶原子的结构示意图可知,该粒子的最外层电子数为2,则与其化学性质相似的粒子结构示意图中最外层电子数也应为2,AB原子的最外层电子数均为2,但A原子的最外层电子数为2,但其核外只有一个电子层,属于稀有气体元素的原子,化学性质稳定;尽管A原子与锶原子最外层电子数相同,但与锶原子的化学性质不相似.
锶原子的最外层电子数是2,在化学反应中易失去2个电子而形成带2个单位正电荷的锶离子,其离子符号为Sr2+.
故答案为:(1)38;5;(2)B;Sr2+.
点评 本题难度不大,考查学生对粒子结构示意图及其意义的理解,了解粒子结构示意图的意义、周期数=原子核外电子层数是正确解题的关键.

练习册系列答案
相关题目
15.探究X、Y、Z三种金属活动性强弱的实验过程如下:(1)取大小相等的三种金属片,分别放入CuSO4溶液中,一段时间后,X、Z表面出现红色物质,Y没有现象.(2)取大小相等的X、Z两种金属片,分别放入相同质量分数的稀盐酸中,X、Z表面都产生气泡,但X产生气泡的速率明显比Z的快.则X、Y、Z三种金属的活动性顺序是( )
| A. | X>Z>Y | B. | Z>Y>X | C. | X>Y>Z | D. | Z>X>Y |
14.某探究小组为测定某纯碱样品(含少量氯化钠杂质)中碳酸钠的含量,进行了以下实验:称量样品置于烧杯中,向其中慢慢滴加稀盐酸,至不再产生气泡为止,测得的有关数据如表所示.
已知碳酸钠与盐酸反应的化学方程式为:Na2CO3+2HCl═2NaCl+H2O+CO2↑.
试计算:(1)反应生成二氧化碳的质量;
(2)纯碱样品中碳酸钠的质量分数;
(3)小慧同学提出用以上方法计算所得碳酸钠的质量分数偏大,她的理由是盐酸易挥发,部分氯化氢挥发出来,导致计算出的二氧化碳质量偏大,从而导致计算的碳酸钠质量分数偏大.
| 物 质 | 样 品 | 加入稀盐酸质量 | 反应后容器中物质的总质量 |
| 质量(g) | 6 | 40 | 43.8 |
试计算:(1)反应生成二氧化碳的质量;
(2)纯碱样品中碳酸钠的质量分数;
(3)小慧同学提出用以上方法计算所得碳酸钠的质量分数偏大,她的理由是盐酸易挥发,部分氯化氢挥发出来,导致计算出的二氧化碳质量偏大,从而导致计算的碳酸钠质量分数偏大.

