题目内容
9.氢化钙(CaH2)固体是一种储氢材料,是登山运动员常用的能源提供剂.【阅读资料】
①碱石灰是氧化钙和氢氧化钠的混合物.
②钙遇水立即发生剧烈反应生成氢氧化钙和氢气.
③氢化钙要密封保存,遇水反应生成氢氧化钙和氢气.
【氢化钙的制备】
氢化钙通常用氢气与钙加热制得.某化学兴趣小组设计的制取装置如图1所示(固定装置省略).
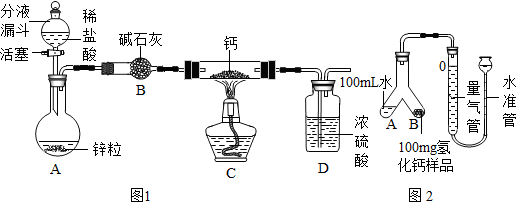
回答下列问题:
(1)装置A中制取氢气的化学方程式为Zn+2HCl=ZnCl2+H2↑.
(2)装置B的作用是吸收水蒸气和氯化氢气体.
(3)装置C中制取氢化钙的化学方程式为Ca+H2$\frac{\underline{\;\;△\;\;}}{\;}$CaH2.
【产品的定量测定】
通过上述方法制得的氢化钙样品中常混有未完全反应的钙(其余可能的杂质忽略不计).样品纯度的测定步骤如下:
①检查装置气密性,装入药品,按如图2(固定装置省略)所示连接仪器.
②调整水准管高度,使量气装置两边的液面保持同一水平.读取液面所在的刻度数据为10.0mL.
③将Y形管慢慢倾斜,直到A端的水全部与B端的样品混合.
④反应结束,冷却至室温,再次读取液面所在刻度数据为110.0mL.
回答下列问题:
(4)如何判断样品与水完全反应:气泡不再产生.
(5)反应生成氢气的体积为100.0mL.
(6)已知该实验条件下,氢气的密度为0.09mg/mL.样品中氢化钙的纯度为88.4%.(结果精确到0.1%)
分析 (1)依据锌粒与稀盐酸反应原理书写方程式;
(2)根据碱石灰的成分和其中物质的性质分析解答;
(3)依据反应物、生成物和反应条件书写方程式;
(4)根据装置特点和氢化钙与水反应生成氢气进行分析;
(5)氢气的体积等于反应前后液面差;
(6)依据氢气的质量=氢气的体积×氢气的密度求出氢气的质量,再结合氢化钙与水反应方程式及钙与水反应方程式,求出氢化钙的质量,进而计算样品中氢化钙的纯度.
解答 解:(1)锌粒与稀盐酸反应生成氯化锌和氢气,用观察法配平,反应的方程式是:Zn+2HCl=ZnCl2+H2↑;
(2)碱石灰是氧化钙和氢氧化钠的混合物,氧化钙与水可反应,氢氧化钠可作干燥剂,且与盐酸能反应,所以该装置的作用是吸收水蒸气和部分氯化氢气体;
(3)钙和氢气在加热的条件下生成氢化钙,方程式是Ca+H2 $\frac{\underline{\;\;△\;\;}}{\;}$CaH2;
(4)由于氢化钙与水反应生成氢气,所以判断样品与水是否完全反应,可以观察右边的量气管中液面,若不再变化,则已完全反应;
(5)氢气的体积等于反应前后液面差,为:110.0mL-10.0mL=100.0mL;
(6)反应生成氢气的质量是:100.0mL×0.09mg/mL=9mg
设样品中氢化钙的质量是X,生成氢气质量为Y,则钙的质量为100mg-X,钙与水反应生成氢气质量为9mg-Y则
CaH2+2H2O═Ca(OH)2+2H2↑
42 4
X Y
$\frac{42}{X}=\frac{4}{Y}$
解得Y=$\frac{2X}{24}$
Ca+2H2O═Ca(OH)2+H2↑
40 2
100mg-X 9mg-Y
$\frac{40}{100mg-X}=\frac{2}{9mg-Y}$将Y=$\frac{2X}{21}$代入,解得X=88.4mg
所以样品中氢化钙的纯度为:$\frac{88.4mg}{100mg}$×100%=88.4%;
答案:
(1)Zn+2HCl=ZnCl2+H2↑;
(2)吸收水蒸气和氯化氢气体;
(3)Ca+H2 $\frac{\underline{\;\;△\;\;}}{\;}$CaH2;
(4)气泡不再产生;
(5)100.0;
(6)88.4%.
点评 本题考查内容全面而综合,解答时要根据相关知识细心分析解答,尤其是计算题,能很好的考查学生对知识的掌握和应用能力.

 导学与测试系列答案
导学与测试系列答案 新非凡教辅冲刺100分系列答案
新非凡教辅冲刺100分系列答案| A. | 木炭在氧气中燃烧发出白光 | |
| B. | 细铁丝在氧气中剧烈燃烧,火星四射,生成一种白色物质 | |
| C. | 镁条在空气中燃烧发出耀眼的白光并放出大量的热 | |
| D. | 硫在空气中燃烧发出淡蓝色火焰,生成有刺激性气味的气体 |
| A. | 分子一定由原子构成 | B. | 分子、原子、离子都可以构成物质 | ||
| C. | 原子得到电子后会形成阴离子 | D. | 原子中一定含有质子、中子和电子 |
| A. | X>Y>Z | B. | Z>X>Y | C. | Z>Y>X | D. | X>Z>Y |
| A. | 清理沼气池用火把照明 | B. | 厨房内煤气泄漏打开排气扇通风 | ||
| C. | 油锅中的油着火用锅盖盖灭 | D. | 冬天用煤取暖时封闭门窗 |