题目内容
某实验小组的同学用氢氧化钙溶液和盐酸进行酸碱中和反应的实验时,向烧杯中的氢氧化钙溶液加入稀盐酸一会后,发现忘记了滴加指示剂。因此,他们停止滴加稀盐酸,并对烧杯内溶液中的溶质成分进行探究。
Ⅰ、写出该中和反应的化学方程式: ① 。
Ⅱ、探究烧杯内溶液中溶质的成分。
【提出问题】该烧杯内溶液中的溶质是什么?
【猜想】猜想一:可能是CaCl2和Ca(OH)2;猜想二:可能只有CaCl2;猜想三: ② 。
【查阅资料】氯化钙溶液呈中性。
【进行实验】
实验步骤:取少量烧杯内溶液于试管中,滴入几滴酚酞溶液,振荡
实验现象: ③ 结论:猜想一不正确
实验步骤:实验步骤取少量烧杯内溶液于另一支试管中,逐滴加入碳酸钠溶液至过量
实验现象: ④ 结论:猜想二不正确,猜想三正确
【反思与拓展】
(1)在分析化学反应后所得物质成分时,除考虑生成物外还需考虑 ⑤ 。
(2)根据所学化学知识,验证烧杯内溶液中的溶质含有HCl,除以上方案外,下列哪些物质单独使用也能完成该实验? ⑥ (填序号)
a.pH试纸 b.铜 c.紫色石蕊溶液 d.硝酸银溶液
(3)烧杯中的溶液未经处理直接倒入下水道,可能造成的危害是 ⑦ (写一条)。要处理烧杯内溶液,使其溶质只含有CaCl2,应向烧杯中加入过量的 ⑧ 。
①Ca(OH)2+2HCl=CaCl2+2H2O ②可能是CaCl2和HCl
③溶液无明显变化(或溶液不变红色)
④先有气体产生,后产生沉淀(只答出一种现象不给分)
⑤反应物的用量 ⑥a c ⑦腐蚀铁质下水管(或污染水源) ⑧石灰石(或CaCO3)
【解析】(1)氢氧化钙与盐酸会发生中和反应生成氯化钙和水:Ca(OH)2+2HCl=CaCl2+2H2O
(2)氢氧化钙与盐酸反应,如氢氧化钙过量则成分为猜想一:CaCl2和Ca(OH)2;如二者恰好完全反应,则成分为猜想二:可能只有CaCl2;哪盐酸过量,则成分为猜想三:可能是CaCl2和HCl。
(3)猜想一的成分为CaCl2和Ca(OH)2,加入酚酞会变红色。因结论为猜想一不正确。所以溶液应呈无色(或溶液无明显变化、溶液未变为红色)
(4)猜想三的成分为CaCl2和HCl,其中盐酸会与碳酸钠反应生成气体。因碳酸钠过量,又会与氯化钙反应生成白色的碳酸钙沉淀。而猜想二中只有CaCl2,反应的现象只有白色沉淀生成。
(5)从上面的分析可知,在分析化学反应后所得物质成分时,除考虑生成物外还需考虑反应物的用量(哪种物质过量)。
(6)因盐酸存在则溶液呈酸性,用pH试纸测试其PH值小于7(CaCl2溶液呈中性不影响) ;与铜不反应;会使紫色石蕊溶液呈红色(CaCl2溶液呈中性不影响);盐酸与氯化钙都与硝酸银溶液产生白色的氯化银沉淀(不可行)所以应选ac。
(7)烧杯中的溶液呈酸性,未经处理直接倒入下水道会腐蚀铁制品管道、造成水污染。
(8)使其溶质只含有CaCl2,可使用碳酸钙与盐酸反应。多余的碳酸钙不溶解,不会影响溶液成分。
点评:本题考查了反应物的过量问题,需要综合考虑物质的性质进行解答。

 通城学典默写能手系列答案
通城学典默写能手系列答案| 实验步骤 | 实验现象 | 实验结论 |
①将等体积的两种无色液体分别加入A、B两个试管中. ②分别向A、B两试管中同时加入等质量(少量)的二氧化锰,观察现象. ②分别向A、B两试管中同时加入等质量(少量)的二氧化锰,观察现象. |
A试管中无明显现象 B试管中有气泡 产生 |
A试管中的无色液 体是 B试管中的无色液体是 |
(2)写出B试管中发生反应的文字表达式:
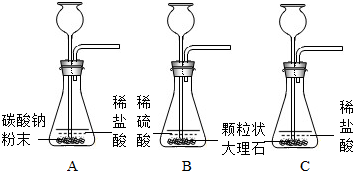
某实验小组的同学用碳酸钠粉末、粒状大理石、稀盐酸、浓盐酸、稀硫酸这几种药品,探究哪两种药品的反应适合在实验室制取CO2气体.请你参与下列的探究并回答问题.
[提出问题]上述酸和碳酸盐的反应是否适合在实验室制取CO2气体.
[方案设计]大家经过讨论,一致认为浓盐酸不适合用于实验室制取CO2气体,原因是浓盐酸挥发出的HCl气体混于CO2中,使制得的气体不纯.小明设计了右图装置来除去CO2中HCl,洗气瓶中盛装的液体可以是______(填序号).
①浓硫酸 ②碳酸氢钠溶液 ③氢氧化钠溶液 ④澄清石灰水
[实验与结论]
该小组设计了三个实验进行对比

(1)请你填写实验C的实验现象和实验结论
| 实验 | 实验现象 | 实验结论 |
| A | 剧烈反应,迅速放出大量气体 | 反应速度过快,气体不便收集,不宜用于实验室制取CO2 |
| B | 产生气泡,速度迅速减慢,几秒钟后反应几乎停止 | 无法持续产生气体,不能用于实验室制取CO2 |
| C | ______ | ______ |
[拓展迁移]
将上述实验C反应后的混合物过滤.对滤液中的溶质,小聪同学提出了以下三种猜想:
①溶质是HCl;②溶质是CaCl2;③溶质是HCl和CaCl2
该小组成员一起讨论后认为,上述三种猜想中有一种是不合理的,你认为不合理的猜想是______(填序号).对小聪的另外两种合理猜想,请你设计实验,并根据不同现象说明溶液中的溶质属于哪一种猜想______.


 被称为“生命之源”的水(H2O)和被称为“绿色氧化剂”的过氧化氢(H2O2),都是由氢、氧两种元素组成的化合物,通常情况下均为无色液体.某实验小组的同学用下面的方法鉴别水和双氧水两瓶无色液体.请回答有关问题:
被称为“生命之源”的水(H2O)和被称为“绿色氧化剂”的过氧化氢(H2O2),都是由氢、氧两种元素组成的化合物,通常情况下均为无色液体.某实验小组的同学用下面的方法鉴别水和双氧水两瓶无色液体.请回答有关问题: