题目内容
生活中处处是化学,请用所学知识回答下列问题.
(1)水垢的主要成分是 .
(2)硝酸铵又称“硝铵”,是一种常用氮肥,向硝酸铵溶液中加入紫色石蕊试液,试液变红色,硝酸铵溶液显 (填“酸性”、“碱性”或“中性”)pH值 7(大于、小于、等于)
(3)食醋中含3%~5%的醋酸,生活中常用食醋清洗水垢【Mg(OH)2和CaCO3】.已知醋酸在水中能电离出CH3COO一和H+;2CH3COOH+CaCO3=(CH3COO)2Ca+H2O+CO2↑.请写出醋酸与Mg(OH)2反应的化学方程式: .
(4)生活中我们知道这样的事实:食盐溶于水但难溶于油,食盐易溶于水而碳酸钙难溶于水;食盐在热水中比在冷水中溶解的多.这说明固体的溶解度主要和 、 、 有关.
(5)将CO2、CaO、NaCl分别溶解在水中,所得溶液pH值大于7的 ,小于7的 ,能使紫色石蕊试液变红色的 ,溶解温度升高的是 .
(1)水垢的主要成分是
(2)硝酸铵又称“硝铵”,是一种常用氮肥,向硝酸铵溶液中加入紫色石蕊试液,试液变红色,硝酸铵溶液显
(3)食醋中含3%~5%的醋酸,生活中常用食醋清洗水垢【Mg(OH)2和CaCO3】.已知醋酸在水中能电离出CH3COO一和H+;2CH3COOH+CaCO3=(CH3COO)2Ca+H2O+CO2↑.请写出醋酸与Mg(OH)2反应的化学方程式:
(4)生活中我们知道这样的事实:食盐溶于水但难溶于油,食盐易溶于水而碳酸钙难溶于水;食盐在热水中比在冷水中溶解的多.这说明固体的溶解度主要和
(5)将CO2、CaO、NaCl分别溶解在水中,所得溶液pH值大于7的
考点:常用盐的用途,固体溶解度的影响因素,酸碱指示剂及其性质,溶液的酸碱性与pH值的关系,书写化学方程式、文字表达式、电离方程式
专题:化学用语和质量守恒定律,常见的盐 化学肥料
分析:(1)根据水垢的主要成分是碳酸钙和氢氧化镁解答;
(2)根据酸性物质能使紫色石蕊变红色,酸性物质溶液的pH值小于7解答;
(3)根据醋酸和氢氧化镁反应生成醋酸镁和水书写;
(4)根据食盐难溶于油易溶于水、碳酸钙碳酸钙难溶于水;食盐在热水中比在冷水中溶解的多分析解答;
(5)根据氧化钙和水反应生成氢氧化钙并放出大量的热,溶液呈碱性;二氧化碳和水反应生成碳酸,溶液呈酸性;氯化钠溶于水不放热也不吸热溶液呈中性解答.
(2)根据酸性物质能使紫色石蕊变红色,酸性物质溶液的pH值小于7解答;
(3)根据醋酸和氢氧化镁反应生成醋酸镁和水书写;
(4)根据食盐难溶于油易溶于水、碳酸钙碳酸钙难溶于水;食盐在热水中比在冷水中溶解的多分析解答;
(5)根据氧化钙和水反应生成氢氧化钙并放出大量的热,溶液呈碱性;二氧化碳和水反应生成碳酸,溶液呈酸性;氯化钠溶于水不放热也不吸热溶液呈中性解答.
解答:解:(1)水垢的主要成分是碳酸钙和氢氧化镁;
(2)酸性物质能使紫色石蕊变红色,酸性物质溶液的pH值小于7;
(3)醋酸和氢氧化镁反应生成醋酸镁和水;
(4)食盐难溶于油易溶于水、碳酸钙碳酸钙难溶于水说明固体的溶解度和溶剂的种类及溶质的种类有关;食盐在热水中比在冷水中溶解的多,说明固体的溶解度和温度有关;
(5)氧化钙和水反应生成氢氧化钙并放出大量的热,溶液呈碱性;二氧化碳和水反应生成碳酸,溶液呈酸性;氯化钠溶于水不放热也不吸热溶液呈中性;
故答案:(1)碳酸钙和氢氧化镁;(2)酸性;小于;(3)2CH3COOH+Mg(OH)2=(CH3COO)2Mg+2H2O;(4)溶质种类、溶剂种类和温度;(5)氧化钙;二氧化碳;二氧化碳;氧化钙.
(2)酸性物质能使紫色石蕊变红色,酸性物质溶液的pH值小于7;
(3)醋酸和氢氧化镁反应生成醋酸镁和水;
(4)食盐难溶于油易溶于水、碳酸钙碳酸钙难溶于水说明固体的溶解度和溶剂的种类及溶质的种类有关;食盐在热水中比在冷水中溶解的多,说明固体的溶解度和温度有关;
(5)氧化钙和水反应生成氢氧化钙并放出大量的热,溶液呈碱性;二氧化碳和水反应生成碳酸,溶液呈酸性;氯化钠溶于水不放热也不吸热溶液呈中性;
故答案:(1)碳酸钙和氢氧化镁;(2)酸性;小于;(3)2CH3COOH+Mg(OH)2=(CH3COO)2Mg+2H2O;(4)溶质种类、溶剂种类和温度;(5)氧化钙;二氧化碳;二氧化碳;氧化钙.
点评:本题考查了生活中的化学知识,注重化学知识的应用和分析能力的考查,注重应用所学知识对生活中的常见物质和现象的考查.

练习册系列答案
相关题目
为纪念化学对社会进步和人类文明所作出的贡献,联合国将2011年定为“国际化学年”.下列说法不正确的是( )
| A、利用化学生产化肥和农药,以增加粮食的产量 |
| B、利用化学合成药物,以抑制细菌和病毒,保障人体健康 |
| C、利用化学开发新能源和新材料,以改善人类的生存条件 |
| D、化石燃料的直接利用,促进了低碳经济的发展 |
下列除去杂质(在括号内)选用的试剂(在箭头右侧)错误的是( )
| A、CO2气体(H2O)→固体氢氧化钠 |
| B、KNO3溶液(NaCl)→降温结晶 |
| C、C (CuO)→稀硫酸 |
| D、CO气体(CO2)→氢氧化钠溶液 |
为测定变质前Ca(OH)2样品[含Ca(OH)2和CaCO3]中Ca(OH)2的质量,张南同学取部分变质的样品12.4g,向其中加入溶质质量分数为7.3%稀盐酸,至不再产生气泡为止,产生气体2.2g,消耗稀盐酸质量为150g.则未变质前Ca(OH)2的质量为( )
| A、7.4g | B、11.1g |
| C、3.7g | D、14.8g |
下列物质的用途由其化学性质决定的是( )
| A、石墨用作润滑剂 |
| B、氧气用于金属切割 |
| C、铜用于制作电线 |
| D、干冰用于人工降雨 |
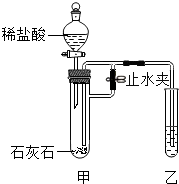 某化学小组在课外活动时利用如图装置进行实验 (图中铁架台等仪器已略去).
某化学小组在课外活动时利用如图装置进行实验 (图中铁架台等仪器已略去).
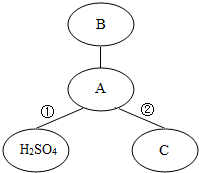 如图中,相连的两种物质间能发生化学反应.请回答有关的问题:
如图中,相连的两种物质间能发生化学反应.请回答有关的问题: