题目内容
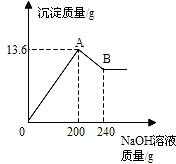 把MgCl2、AlCl3两种固体组成的混合物溶于水后,在所得溶液中逐滴加入10%的NaOH溶液,加入NaOH溶液的质量与生成沉淀质量如图所示.[已知:Al(OH)3+NaOH═NaAlO2+XH2O,NaAlO2可溶于水]) 试回答:
把MgCl2、AlCl3两种固体组成的混合物溶于水后,在所得溶液中逐滴加入10%的NaOH溶液,加入NaOH溶液的质量与生成沉淀质量如图所示.[已知:Al(OH)3+NaOH═NaAlO2+XH2O,NaAlO2可溶于水]) 试回答:(1)X的值为
(2)B点的沉淀物的化学式是
(3)原混合物中AlCl3质量.
考点:根据化学反应方程式的计算,质量守恒定律及其应用
专题:综合计算(图像型、表格型、情景型计算题)
分析:(1)根据质量守恒定律即可计算出X的值;
(2)向MgCl2、AlCl3两种物质的混合溶液中逐滴加入NaOH溶液,MgCl2、AlCl3与NaOH生成Mg(OH)2和Al(OH)3沉淀到恰好完全反应即图中A点;然后Al(OH)3沉淀与所加入的NaOH溶液继续发生反应Al(OH)3+NaOH═NaAlO2+2H2O,生成NaAlO2可溶于水而使沉淀质量减少,至图中B点时恰好完全反应,之后加入的NaOH溶液不再发生反应,沉淀质量不再改变;
(3)根据反应的化学方程式Al(OH)3+NaOH═NaAlO2+2H2O,由消耗NaOH的质量可计算13.6g混合沉淀物中的质量Al(OH)3,沉淀的总质量与沉淀Al(OH)3质量的差即生成Mg(OH)2沉淀的质量,然后分别根据生成两种沉淀反应的化学方程式,由两种沉淀的质量计算原混合物中MgCl2的质量、AlCl3的质量.
(2)向MgCl2、AlCl3两种物质的混合溶液中逐滴加入NaOH溶液,MgCl2、AlCl3与NaOH生成Mg(OH)2和Al(OH)3沉淀到恰好完全反应即图中A点;然后Al(OH)3沉淀与所加入的NaOH溶液继续发生反应Al(OH)3+NaOH═NaAlO2+2H2O,生成NaAlO2可溶于水而使沉淀质量减少,至图中B点时恰好完全反应,之后加入的NaOH溶液不再发生反应,沉淀质量不再改变;
(3)根据反应的化学方程式Al(OH)3+NaOH═NaAlO2+2H2O,由消耗NaOH的质量可计算13.6g混合沉淀物中的质量Al(OH)3,沉淀的总质量与沉淀Al(OH)3质量的差即生成Mg(OH)2沉淀的质量,然后分别根据生成两种沉淀反应的化学方程式,由两种沉淀的质量计算原混合物中MgCl2的质量、AlCl3的质量.
解答:解:(1)根据质量守恒定律,反应前后各种元素的原子个数相等,由反应前氢原子的个数为4,故X的值为2;故填:2.
(2)根据MgCl2、AlCl3与NaOH生成Mg(OH)2和Al(OH)3沉淀,可判断图中A点的沉淀物为Al(OH)3、Mg(OH)2的混合物;随后Al(OH)3沉淀与所加入的NaOH溶液继续发生反应Al(OH)3+NaOH═NaAlO2+2H2O,生成可溶于水的NaAlO2,因此图中B点的沉淀物全部为Mg(OH)2;故填:Mg(OH)2;
(3)据图,与氢氧化铝反应的氢氧化钠溶液质量为240g-200g=40g,设此时消耗氢氧化铝的质量为x
Al(OH)3+NaOH═NaAlO2+2H2O
78 40
x 40g×10%=4g
=
,
x=7.8g
设原混合物中AlCl3的质量为y,MgCl2的质量为z
AlCl3+3NaOH═Al(OH)3↓+3NaCl
133.5 78
y 7.8g
=
,
y=13.35g
答:混合物中AlCl3质量13.35g.
(2)根据MgCl2、AlCl3与NaOH生成Mg(OH)2和Al(OH)3沉淀,可判断图中A点的沉淀物为Al(OH)3、Mg(OH)2的混合物;随后Al(OH)3沉淀与所加入的NaOH溶液继续发生反应Al(OH)3+NaOH═NaAlO2+2H2O,生成可溶于水的NaAlO2,因此图中B点的沉淀物全部为Mg(OH)2;故填:Mg(OH)2;
(3)据图,与氢氧化铝反应的氢氧化钠溶液质量为240g-200g=40g,设此时消耗氢氧化铝的质量为x
Al(OH)3+NaOH═NaAlO2+2H2O
78 40
x 40g×10%=4g
| 78 |
| x |
| 40 |
| 4g |
x=7.8g
设原混合物中AlCl3的质量为y,MgCl2的质量为z
AlCl3+3NaOH═Al(OH)3↓+3NaCl
133.5 78
y 7.8g
| 133.5g |
| y |
| 78 |
| 7.8g |
y=13.35g
答:混合物中AlCl3质量13.35g.
点评:在对表示反应的图象中的曲线进行分析时,抓住曲线起点、折点的特殊性,分析此时反应的发生情况对解决此类问题尤其重要.

练习册系列答案
 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案
相关题目
下列说法正确的是( )
| A、氢氧化钠能使无色酚酞溶液变红 |
| B、水能是新能源 |
| C、溶液都能导电 |
| D、干冰不是冰 |
 金是一种贵重金属,一直以来都充当着货币的作用(部分信息如图所示).下列说法错误的是( )
金是一种贵重金属,一直以来都充当着货币的作用(部分信息如图所示).下列说法错误的是( )| A、该元素的相对原子质量为197.0g |
| B、该元素的原子序数为79 |
| C、该元素的核外电子数为79 |
| D、汞和金都属于金属元素 |
下列与水有关的说法正确的是( )
| A、水结成冰属于化学变化 |
| B、通过蒸馏可将硬水软化 |
| C、水资源丰富无需节约用水 |
| D、工业污水可以直接排放 |

 M常为骨质疏松的患者需补充的元素,其原子结构示意图如图:
M常为骨质疏松的患者需补充的元素,其原子结构示意图如图: