题目内容
20. 海洋中蕴含着丰富的资源,海洋资源开发前景十分广阔.
海洋中蕴含着丰富的资源,海洋资源开发前景十分广阔.(1)海水晒盐.2015年我国海盐年产量高达5797万吨,居世界第一位.目前从海水中提取食盐的方法主要为“盐田法”.在蒸发池中促进水分蒸发的过程中,主要利用了下列各项中的(填选项序号)③.
①潮汐能 ②生物能 ③太阳能 ④化学能
(2)海水制“碱”.我国化学家侯德榜创立的“侯氏制碱法”,就是以海水“晒盐”得到的氯化钠为原料制得NaHCO3,再将NaHCO3稍加热即分解得到纯碱,其生产过程如图所示.

通过过程②可得到碳酸氢钠,化学方程式为NaCl+NH4HCO3═NaHCO3+X.请写出X的化学式NH4Cl.
(3)右图是A、B两种物质的溶解度曲线.回答下列问题:
①请说出图中P点的含义在t1℃时AB的溶解度相等.
②t2℃时,A的饱和溶液中溶质的质量分数为20%.
③将A和B的饱和溶液分别由t2℃降温到t1℃时(假设溶剂质量不变).请判断它们溶液中溶质的质量分数如何变化?简要写出理由.
分析 (1)根据太阳能是取之不尽用之不竭的清洁能源进行分析;
(2)根据反应前后原子的种类和数量不变解答;
(3)根据已有的饱和溶液的形成、溶解度曲线的意义进行分析解答即可.
解答 解:(1)太阳能是取之不尽用之不竭的清洁能源,所以在蒸发池中促进水分蒸发,主要是利用了太阳能;
(2)根据化学反应前后原子种类和数目不变,反应前各物质中N、H、C、O、Na、Cl元素的原子个数为:N 1,H 5,C 1,O 3,Na 1,Cl 1;而反应后NaHCO3的原子个数为:Na 1,H 1,C 1,O 3;则反应物X的一个分子中含有1个N原子、4个H原子和1个Cl原子;
(3)①P点表示在t1℃时AB的溶解度相等(t1℃时AB两饱和溶液的溶质质量分数相等),故填:在t1℃时AB的溶解度相等(t1℃时AB两饱和溶液的溶质质量分数相等);
②t2℃时,A的溶解度是25g,故A的饱和溶液中溶质的质量分数为$\frac{25g}{100g+25g}$=20%;
③将A和B的饱和溶液,由t2℃降温到t1℃时(假设溶剂质量不变),A的溶质质量分数减小,B的溶质质量分数不变;降温时,A物质的溶解度减小,它的饱和溶液中析出晶体,溶质质量减小,溶剂质量不变,溶质质量分数减小;B物质的溶解度增大,它的饱和溶液变为不饱和溶液,不析出晶体,溶质质量分数不变.
故答案为:(1)③;
(2)NH4Cl;
(3)①在t1℃时AB的溶解度相等;
②20%;
③A的溶质质量分数减小,B的溶质质量分数不变;降温时,A物质的溶解度减小,它的饱和溶液中析出晶体,溶质质量减小,溶剂质量不变,溶质质量分数减小;B物质的溶解度增大,它的饱和溶液变为不饱和溶液,不析出晶体,溶质质量分数不变.
点评 本题主要考查了海水综合利用的知识,难度不大,需要找准考查的知识点,即可正确解答.

 走进文言文系列答案
走进文言文系列答案| A. | 测定碱溶液的pH:用水先将pH试纸润湿,会导致结果偏大 | |
| B. | 去除粗盐中难溶性杂质:所得精盐未完全干燥就称量,会导致产率偏小 | |
| C. | 测定空气中O2含量:将红磷点燃慢慢伸入集气瓶并塞紧瓶塞,会导致测定结果偏低 | |
| D. | 检验CO2的性质:用较浓盐酸制得的气体通入澄清石灰水,会导致看不到浑浊现象 |
| A. | 75% | B. | 80% | C. | 85% | D. | 90% |
| A. | 单质中只含有一种元素,因此只含有一种元素的物质一定是单质 | |
| B. | 在化合物里,正负化合价的代数和为零,所以在同一化合物中金属元素显正价,则非金属 元素一定显负价 | |
| C. | 稀有气体元素的原子最外层电子数为8(氦除外),因此微粒一定是稀有气体元素 的原子 | |
| D. | 碱性溶液能使酚酞试液变红色,因此能使酚酞试液变红色的溶液的PH-定大于7 |
| A. | 分子在不断运动 | B. | 分子很小 | C. | 分子间有间隔 | D. | 分子不可再分 |
| A. | 铝块能制成铝箔是利用了铝的延展性 | |
| B. | 生铁可以完全溶解在足量的稀盐酸中 | |
| C. | 合金硬度一般比组成它的纯金属大 | |
| D. | 回收利用废金属可减少对环境的污染 |
| A. |  分子总是不断地运动 | B. |  水是由氢气和氧气组成 | ||
| C. |  二氧化碳能使紫色石蕊变红 | D. |  质量守恒定律 |
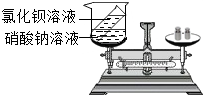 小章同学设计了如图所示的实验来验证质量守恒定律,在实验前左盘总质量为m,将试管中的溶液倒入烧杯后,左盘总质量为m,小章同学认为实验成功,你认为该实验设计合理吗?为什么?
小章同学设计了如图所示的实验来验证质量守恒定律,在实验前左盘总质量为m,将试管中的溶液倒入烧杯后,左盘总质量为m,小章同学认为实验成功,你认为该实验设计合理吗?为什么? 如图所示,将少量液体X加入到烧瓶中,观察到气球逐渐鼓胀.如表中液体X和固体Y的组合,符合题意的是( )
如图所示,将少量液体X加入到烧瓶中,观察到气球逐渐鼓胀.如表中液体X和固体Y的组合,符合题意的是( )