题目内容
过碳酸钠(Na2CO4)和盐酸反应的化学方程式为2Na2CO4+4HCl═4NaCl+2CO2↑+O2↑+2H2O,商品过碳酸钠中往往含有少量的碳酸钠,为了测定其纯度,现称取0.9g样品进行实验.供实验选用的仪器、试剂如图所示.
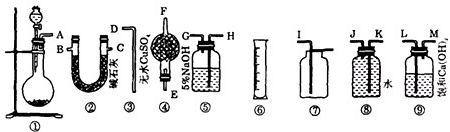
(1)为了使实验尽可能简单,应选用的装置是 (填编号①、②、…).
(2)所选用的装置的连接顺序是 (填字母,胶管已略去).
(3)为了能通过实验和计算求得样品的纯度.应通过排水量气装置测定出氧气的体积,若所测定的氧气的体积折算为质量表示,且为mg,则样品中Na2CO4的质量分数为 .

(1)为了使实验尽可能简单,应选用的装置是
(2)所选用的装置的连接顺序是
(3)为了能通过实验和计算求得样品的纯度.应通过排水量气装置测定出氧气的体积,若所测定的氧气的体积折算为质量表示,且为mg,则样品中Na2CO4的质量分数为
考点:实验探究物质的组成成分以及含量,常见气体的检验与除杂方法,盐的化学性质,根据化学反应方程式的计算
专题:科学探究
分析:根据反应物的状态和反应条件选择反应发生装置;根据实验思路,要测生成氧气的量,可用排水法,必须先除去生成的二氧化碳,由此选择实验装置;
依据测定的氧气体积计算物质的量,结合化学方程式计算过碳酸钠物质的量计算得到质量分数.
依据测定的氧气体积计算物质的量,结合化学方程式计算过碳酸钠物质的量计算得到质量分数.
解答:解:
(1)过碳酸钠和盐酸反应为固体和液体反应且不需要加热,故选择装置①.要测定生成氧气的量,需要先除去二氧化碳,可用氢氧化钠溶液吸收二氧化碳,再通入水中,F量筒中水的体积即为E装置中氧气排开水的体积,二者体积相等.则为了使实验尽可能简单,应选用的装置是 ①⑤⑧③⑥;
(2)由(1)分析,可知:所选用的装置的连接顺序是 AHGJKD;
(3)依据测定的氧气体积计算物质的量,结合化学方程式计算过碳酸钠物质的量计算得到质量分数,样品质量0.9g,测定的氧气的体积折算为质量表示,且为mg,依据其化学方程式为:
设反应的过碳酸钠的质量为x.
2Na2CO4+2H2SO4═2Na2SO4+2CO2↑+O2↑+2H2O,
244 32
x mg
则
=
,解得x=
,故反应的过碳酸钠的质量
,
则该样品中Na2CO4的质量分数=
×100%=
×100%,
故答案为:
(1)①⑤⑧③⑥.(2)AHGJKD.(3)
×100%.
(1)过碳酸钠和盐酸反应为固体和液体反应且不需要加热,故选择装置①.要测定生成氧气的量,需要先除去二氧化碳,可用氢氧化钠溶液吸收二氧化碳,再通入水中,F量筒中水的体积即为E装置中氧气排开水的体积,二者体积相等.则为了使实验尽可能简单,应选用的装置是 ①⑤⑧③⑥;
(2)由(1)分析,可知:所选用的装置的连接顺序是 AHGJKD;
(3)依据测定的氧气体积计算物质的量,结合化学方程式计算过碳酸钠物质的量计算得到质量分数,样品质量0.9g,测定的氧气的体积折算为质量表示,且为mg,依据其化学方程式为:
设反应的过碳酸钠的质量为x.
2Na2CO4+2H2SO4═2Na2SO4+2CO2↑+O2↑+2H2O,
244 32
x mg
则
| 244 |
| x |
| 32 |
| mg |
| 61mg |
| 8 |
| 61mg |
| 8 |
则该样品中Na2CO4的质量分数=
| ||
| 0.9g |
| 305m |
| 36 |
故答案为:
(1)①⑤⑧③⑥.(2)AHGJKD.(3)
| 305m |
| 36 |
点评:本题考查化学实验的装置连接及判断反应物过量问题,解题时要注意反应发生装置的选取依据的原则是反应物状态和反应条件,实验设计要注意语言描述的准确性.

练习册系列答案
 智能训练练测考系列答案
智能训练练测考系列答案
相关题目
 2008年初,我国南方地区遭受了一场特大雪灾,道路结冰,给交通带来极大不便.为了快速消除道路上的积雪,交通部门使用了大量的融雪剂,某公司生产的融雪剂是由NaCl、CaCl2、Na2CO3和CuSO4中的一种或两种物质组成.化学兴趣小组的小红和小兰对融雪剂产生很大的兴趣并对融雪剂的成分进行积极的探究.
2008年初,我国南方地区遭受了一场特大雪灾,道路结冰,给交通带来极大不便.为了快速消除道路上的积雪,交通部门使用了大量的融雪剂,某公司生产的融雪剂是由NaCl、CaCl2、Na2CO3和CuSO4中的一种或两种物质组成.化学兴趣小组的小红和小兰对融雪剂产生很大的兴趣并对融雪剂的成分进行积极的探究. 已知某元素的原子结构示意图,则该元素原子所含的质子数为
已知某元素的原子结构示意图,则该元素原子所含的质子数为 某学生拟通过测定粗锌(杂质与稀硫酸不反应)与稀硫酸反应产生的气体体积,来测定粗锌中锌的纯度.现有粗锌、稀硫酸、试管、镊子、单孔橡皮塞、导气管、托盘天平、量筒、水槽、铁架台(附铁夹)等仪器、药品.
某学生拟通过测定粗锌(杂质与稀硫酸不反应)与稀硫酸反应产生的气体体积,来测定粗锌中锌的纯度.现有粗锌、稀硫酸、试管、镊子、单孔橡皮塞、导气管、托盘天平、量筒、水槽、铁架台(附铁夹)等仪器、药品.
