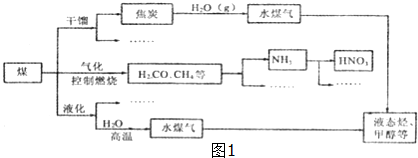
题目内容
5.如图所示中的①、②是氟元素、钙元素在元素周期表中的信息,A.B.C.D是四种粒子的结构示意图.请你回答:

(1)钙元素的质子数为20;
(2)D中的X=8;
(3)C的粒子符号是Cl-.
分析 (1)根据图中元素周期表可以获得的信息:左上角的数字表示原子序数;字母表示该元素的元素符号;中间的汉字表示元素名称;汉字下面的数字表示相对原子质量,进行分析解答即可.
(2)根据原子中核电荷数=核内质子数,进行分析解答.
(3)根据微粒符号的写法来分析.
解答 解:(1)根据钙元素周期表中的一格中获取的信息,左上角的数字为20,表示原子序数为20;根据原子序数=核电荷数=质子数,则该元素的原子质子数为20.故填:20;
(2)原子中核电荷数=核内质子数,18=2+8+X,X=8.故填:8;
(3)C微粒核内有17个质子,核外有18个电子,是氯离子,故填:Cl-.
点评 本题难度不大,灵活运用元素周期表中元素的信息、明确粒子中核内质子数和核外电子数之间的关系、决定元素化学性质的因素等是即可正确决定本题.

练习册系列答案
相关题目
17.把A、B、C、D四种纯净物放在一密闭容器中,在一定条件下充分反应,反应前后各物质的质量如表:
(1)反应后D的质量是19.6g;
(2)参加反应的B的质量是24.5g;
(3)容器中发生反应的反应类型是分解反应(填写基本反应类型);
(4)物质C可能是催化剂.
| 物质 | A | B | C | D |
| 反应前质量/g | 2 | 26.5 | 2 | 10 |
| 反应后质量/g | 16.9 | 2 | 2 | 待测 |
(2)参加反应的B的质量是24.5g;
(3)容器中发生反应的反应类型是分解反应(填写基本反应类型);
(4)物质C可能是催化剂.
14.最近科学家发现,水在-157℃超低温、正常压力或真空条件下仍呈液态,比蜂蜜还粘稠.下列关于这种“高密度液态水”的说法正确的是( )
| A. | 构成“高密度液态水”的分子与普通水的分子不同 | |
| B. | “高密度液态水”分子不再运动 | |
| C. | “高密度液态水”中氢、氧两种元素的质量比为1:8 | |
| D. | “高密度液态水”分子间的间隔比普通水大 |