题目内容
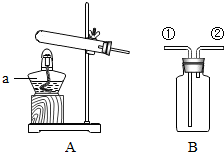
7.如图所示实验仪器分别获经组合可进行多项常见化学实验.
(1)若需要配置500g质量分数为0.5%的高锰酸钾溶液进行松籽浸种实验.配制该溶液时,所需固体高锰酸钾的质量为2.5g,水为497.5mL(水的密度为1g/cm3);本实验中必须用到图中仪器C和E(填仪器字母编号).
(2)粗盐中主要杂质为不溶物及少量的CaCl2和MgSO4.
①除去粗盐中难溶性杂质实验时,要进行过滤操作,此操作除需要用到图中C、D仪器外,还需要图中没有的玻璃仪器:漏斗和玻璃棒.
②过滤后,滤液中溶质除NaCl外,还含有上述两种可溶性杂质,为除掉这些杂质,可加入过量的NaOH溶液、Na2CO3溶液、BaCl2溶液三种试剂,三种试剂的添加顺序为NaOH、BaCl2、Na2CO3(写一种即可),此过程中共生成4种难溶物;加入过量Na2CO3溶液的目的是除去氯化钙和过量的氯化钡.
分析 (1)根据溶质质量=溶液质量×溶质质量分数,溶剂质量=溶液质量-溶质质量来计算,固体药品要用托盘天平来称量以及量筒的使用注意事项进行解答;
(2)根据过滤操作用到的玻璃仪器和除杂质后过滤完毕滤液中存在的物质考虑;加入过量的氢氧化钠溶液可以除去硫酸镁中的镁离子,加入过量的氯化钡溶液可以除去硫酸镁中的硫酸根离子,加入过量的碳酸钠溶液可以除去氯化钙和过量的氯化钡;
解答 解:(1)溶质质量=溶液质量×溶质质量分数,所以500g×0.5%=2.5g;需要水的质量为500g-2.5g=497.5g,因为水的密度为1g/cm3,所以水的体积为497.5mL.称量高锰酸钾是用托盘天平;量取所需水时,若俯视读数,使得水的实际质量偏小,所以溶质质量分数偏大.
故答案为:2.5;497.5;E;
(2)过滤操作中用到烧杯、漏斗、玻璃棒和铁架台,所以玻璃仪器是烧杯、漏斗、玻璃棒;加入过量的氢氧化钠溶液可以除去硫酸镁中的镁离子,加入过量的氯化钡溶液可以除去硫酸镁中的硫酸根离子,加入过量的碳酸钠溶液可以除去氯化钙和过量的氯化钡;此过程中生成氢氧化镁沉淀、硫酸钡沉淀、碳酸钙、碳酸钡沉淀;最后加入过量Na2CO3溶液的目的是除去氯化钙和过量的氯化钡.
故答案为:漏斗;NaOH、BaCl2、Na2CO3;4;除去氯化钙和过量的氯化钡
答案:
(1)2.5;497.5;E;
(2)漏斗;NaOH、BaCl2、Na2CO3;4;除去氯化钙和过量的氯化钡.
点评 此题涉及到的是仪器的选用、除杂的问题、有关溶质质量分数的计算问题,是化学考试的内容之一.

练习册系列答案
 轻巧夺冠周测月考直通名校系列答案
轻巧夺冠周测月考直通名校系列答案
相关题目
17.宁夏银川到陕西西安的银西高铁将在今年下半年开工建设.为适应提速要求需把短轨连成长轨,常用反应:xAl+Fe2O3 $\frac{\underline{\;高温\;}}{\;}$Al2O3+xFe进行焊接,该反应发生后,不需要再持续加热就可保持高温继续进行,方便野外操作.下列说法不正确的是( )
| A. | Al2O3为氧化物 | B. | 该反应为置换反应 | ||
| C. | 该反应方程式中的x为3 | D. | 该反应会放出大量热 |



 某学校实验小组的同学欲用氯酸钾来制取氧气,并回收提纯氯化钾和二氧化锰.
某学校实验小组的同学欲用氯酸钾来制取氧气,并回收提纯氯化钾和二氧化锰.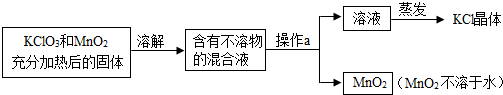

 如图是初中化学中常见物质间的转化关系,其中甲、乙为单质,A、B、C、D为化合物,且A与B的组成元素相同,C与D的组成元素也相同.其中“→”表示能生成这种物质,其余反应条件、部分反应物已略去.试推断:
如图是初中化学中常见物质间的转化关系,其中甲、乙为单质,A、B、C、D为化合物,且A与B的组成元素相同,C与D的组成元素也相同.其中“→”表示能生成这种物质,其余反应条件、部分反应物已略去.试推断: