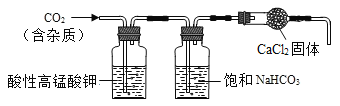
题目内容
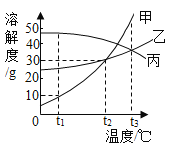
【题目】NaNO3和KNO3的溶解度表及溶解度曲线如下。下列说法正确的是( )
温度/℃ | 20 | 30 | 50 | 60 | 80 | |
溶解度S/g | NaNO3 | 87.6 | 94.9 | 110 | 122 | 148 |
KNO3 | 31.6 | 45.3 | 85.5 | 110 | 167 | |
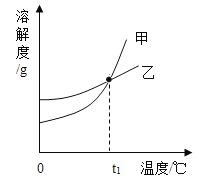
A.甲表示NaNO3溶解度曲线
B.40 ℃时,饱和溶液的溶质质量分数KNO3>NaNO3
C.t1应介于60 ℃~80 ℃
D.80 ℃时,KNO3饱和溶液中含有少量NaNO3,要得到较纯净的KNO3晶体,可采用蒸发结晶、过滤等操作
【答案】C
【解析】
A、由表格数据可知:硝酸钠溶解度受温度影响较小,硝酸钾溶解度受温度影响较大,则甲表示硝酸钾溶解度曲线;故选项错误;
B、小于60℃时,硝酸钾的溶解度都小于硝酸钠,则40 ℃时,饱和溶液的溶质质量分数KNO3<NaNO3;故选项错误;
C、60 ℃时,硝酸钠的溶解度大于硝酸钾,80 ℃时,硝酸钠的溶解度小于硝酸钾,则60 ℃~80 ℃之间,硝酸钾和硝酸钠的溶解度相等,所以t1应介于60 ℃~80 ℃;故选项正确;
D、硝酸钠溶解度受温度影响较小,硝酸钾溶解度受温度影响较大,80 ℃时,KNO3饱和溶液中含有少量NaNO3,要得到较纯净的KNO3晶体,可采用降温结晶、过滤等操作;故选项错误;
故选:C。

【题目】用如图所示装置,在常温下,分别进行研究燃烧条件和研究氧气性质的实验。已知:白磷的着火点为40℃,实验时打开导管中的开关。
步骤 | (实验1)研究燃烧条件 | (实验2)研究氧气性质 |
Ⅰ | 烧杯中盛有80℃的热水,分别在燃烧匙和烧杯中导管口放置一小块白磷,塞紧瓶塞 | 烧杯中盛有NaOH溶液,燃烧匙中放入木炭,点燃木炭后迅速将燃烧匙伸入瓶中,塞紧瓶塞 |
Ⅱ | 推入适量H2O2溶液 | 推入适量H2O2溶液 |
(1)实验1中,推入H2O2溶液前,燃烧匙和水中的白磷均不燃烧,燃烧匙中白磷不燃烧的原因是_____; 烧杯中白磷未燃烧的原因是_____; 推入H2O2溶液后,观察到烧杯中的现象是_____。
(2)实验2中,推入H2O2溶液后,观察到木炭燃烧得更剧烈,由此得出氧气的性质是_____;木炭熄灭后冷却一段时间,烧杯中的溶液_____(填“能”或“否”)流入集气瓶。
【题目】下表是20℃时部分物质的溶解度数据。
物质 | NaOH | AlCl3 | Al(OH)3 |
溶解度/g | 109 | 69.9 | 0.0015 |
氢氧化铝为两性氢氧化物,能与酸反应也,能与强碱反应,与氢氧化钠反应能生成偏铝酸钠(NaAlO2)和水
(1)配制溶液。其中配制20℃时100g饱和氯化铝溶液的基本步骤是:称取氯化铝固体—量取水—溶解—装瓶贴标签。
①称取氯化铝固体的质量_____________g。
②量取水加加入烧杯溶解。
③装瓶后贴标签,在标签上填写:_____________。
(2)进行性质探究实验。20℃时,根据数据回答下列问题:
①向氯化铝溶液中通入氢氧化钠直至过量,先生成Al(OH)3,再转化为NaAlO2,可观察到的现象是___________;Al(OH)3与氢氧化钠的反应方程式反应__________。
②将100g饱和氯化铝溶液,与足量的氢氧化钠反应能生成NaAlO2___________g,同时需10%氢氧化钠溶液的质量至少为__________g。(计算结果精确到0.1)