题目内容
(1)某兴趣小组的同学从实验室收集到一桶含有FeSO4、CuSO4的废液,他们想从中回收金属铜和硫酸亚铁晶体,设计了如图1所示的实验方案.结合实验方案回答下列问题:
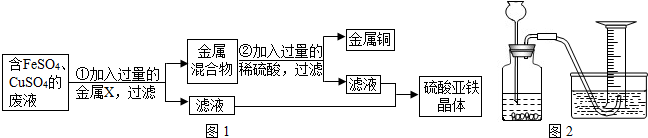
①步骤①中,金属X是 ,该反应的化学方程式为 ;
②步骤②中,加入过量稀硫酸的目的是 ;
③从滤液中获得硫酸亚铁晶体采用的方法是 .
(2)为了比较甲、乙两种金属的活动性强弱和相对原子质量大小,小吴设计了一套实验装置(如图2),他取两种金属(表面积相同)各m克,分别加入足量的稀硫酸(相同质量和质量分数)进行反
应,在相同条件下测定不同时间内收集到的气体体积,实验记录如下表:
①由实验结果可知:金属活动性较强的是 .
②为了使得到的实验数据准确,小吴开始收集气体的时间点应该是 .
A.导管口一有气泡冒出时 B.冒出气泡连续且均匀时 C.检验产生的气体纯净时
③根据已有实验数据,要比较甲、乙两种金属的相对原子质量大小,还需知道 .
A.参加反应的硫酸质量 B.生成物中金属元素的化合价.

①步骤①中,金属X是
②步骤②中,加入过量稀硫酸的目的是
③从滤液中获得硫酸亚铁晶体采用的方法是
(2)为了比较甲、乙两种金属的活动性强弱和相对原子质量大小,小吴设计了一套实验装置(如图2),他取两种金属(表面积相同)各m克,分别加入足量的稀硫酸(相同质量和质量分数)进行反
应,在相同条件下测定不同时间内收集到的气体体积,实验记录如下表:
| 反应时间(秒) | 20 | 40 | 60 | 80 | 100 | 120 | 140 | |
| 收集到的气体体积(毫升) | 甲金属 | 25 | 60 | 95 | 130 | 160 | 170 | 170 |
| 乙金属 | 30 | 75 | 120 | 150 | 150 | 150 | 150 | |
②为了使得到的实验数据准确,小吴开始收集气体的时间点应该是
A.导管口一有气泡冒出时 B.冒出气泡连续且均匀时 C.检验产生的气体纯净时
③根据已有实验数据,要比较甲、乙两种金属的相对原子质量大小,还需知道
A.参加反应的硫酸质量 B.生成物中金属元素的化合价.
考点:金属的化学性质,结晶的原理、方法及其应用,书写化学方程式、文字表达式、电离方程式
专题:金属与金属材料
分析:(1)铁能和硫酸铜反应生成硫酸亚铁和铜;
铜不能和稀硫酸反应,铁和稀硫酸反应生成硫酸亚铁和氢气;
蒸发硫酸亚铁溶液可以得到硫酸亚铁晶体;
(2)金属越活泼,和稀硫酸反应的速率越快,单位时间内生成的氢气越多;
如果知道生成物中金属元素的化合价,就可以书写反应的化学方程式,根据化学方程式、反应物、生成物的质量可以计算金属的相对原子质量.
铜不能和稀硫酸反应,铁和稀硫酸反应生成硫酸亚铁和氢气;
蒸发硫酸亚铁溶液可以得到硫酸亚铁晶体;
(2)金属越活泼,和稀硫酸反应的速率越快,单位时间内生成的氢气越多;
如果知道生成物中金属元素的化合价,就可以书写反应的化学方程式,根据化学方程式、反应物、生成物的质量可以计算金属的相对原子质量.
解答:解:(1)①步骤①中,金属X是铁,铁和硫酸铜反应的化学方程式为:Fe+CuSO4═FeSO4+Cu;
②步骤②中,加入过量稀硫酸的目的是使铁完全反应;
③从滤液中获得硫酸亚铁晶体采用的方法是蒸发结晶.
故填:铁;Fe+CuSO4═FeSO4+Cu;使铁完全反应;蒸发结晶.
(2)①由实验结果可知,单位时间内,金属乙与稀硫酸反应生成的气体多,比金属甲活泼;
②为了使得到的实验数据准确,小吴开始收集气体的时间点应该是导管口一有气泡冒出时,因为要测定金属产生氢气的快慢,应该是收集金属反应产生的所有气体,因此导管口一有气泡冒出时就要收集.
③根据已有实验数据,要比较甲、乙两种金属的相对原子质量大小,还需知道生成物中金属元素的化合价.
故填:乙;A;B.
②步骤②中,加入过量稀硫酸的目的是使铁完全反应;
③从滤液中获得硫酸亚铁晶体采用的方法是蒸发结晶.
故填:铁;Fe+CuSO4═FeSO4+Cu;使铁完全反应;蒸发结晶.
(2)①由实验结果可知,单位时间内,金属乙与稀硫酸反应生成的气体多,比金属甲活泼;
②为了使得到的实验数据准确,小吴开始收集气体的时间点应该是导管口一有气泡冒出时,因为要测定金属产生氢气的快慢,应该是收集金属反应产生的所有气体,因此导管口一有气泡冒出时就要收集.
③根据已有实验数据,要比较甲、乙两种金属的相对原子质量大小,还需知道生成物中金属元素的化合价.
故填:乙;A;B.
点评:要会利用金属活动顺序表设计实验,去验证金属的还原性强弱.氢前边的金属会与稀硫酸、盐酸反应,但氢后边的金属不会与稀硫酸、盐酸反应,前边的金属会把后边的金属从其盐溶液中置换出来.

练习册系列答案
 期末金牌卷系列答案
期末金牌卷系列答案 轻松课堂标准练系列答案
轻松课堂标准练系列答案
相关题目
根据你的生活经验和所学的化学知识判断,下列做法错误的是( )
| A、提倡用节能灯替换家里的白炽灯 |
| B、用聚乙烯塑料制作食品包装袋 |
| C、利用洗洁精的乳化作用清洗餐具上的油污 |
| D、将硫酸铜溶液喷洒在韭菜上以保持鲜绿色 |
正确反映对应变化关系的图象是( )
 |  |  |  |
| ①分别稀释NaOH溶液和H2SO4溶液 | ②在盛有空气的密闭容器中点燃红磷 | ③H2与过量O2在密闭容器中充分反应 | ④将水通电电解 一段时间 |
| A、①②③ | B、③④ |
| C、②③④ | D、①②③④ |
 以下五种为初中常见物质,均由表中元素组成
以下五种为初中常见物质,均由表中元素组成 


