题目内容
4.某同学探究金属的化学性质的过程如图所示,问:
(1)金属X为铁;
(2)写出试管Ⅱ中发生反应化学方程式Fe+H2SO4═FeSO4+H2↑;
(3)滤液B中的溶质为(写化学式)FeSO4;ZnSO4.
分析 根据最后得到浅绿色溶液可知,X为铁,然后根据金属的活动性顺序进行分析解答.
解答 解:根据最后得到浅绿色溶液可知,X为铁且过量;铁与硫酸铜反应生成铜和硫酸亚铁,硫酸锌不反应,故滤渣A为铜和铁的混合物,加硫酸与铁反应生成氢气和硫酸亚铁,溶液呈浅绿色,滤液B中含有硫酸锌和硫酸亚铁.
(1)根据最后得到浅绿色溶液可知,X为铁;
(2)试管Ⅱ中发生反应化学方程式:Fe+H2SO4═FeSO4+H2↑;
(3)滤液B中的溶质为:FeSO4;ZnSO4.
故答案为:(1)铁;
(2)Fe+H2SO4═FeSO4+H2↑;
(3)FeSO4;ZnSO4.
点评 本题难度不大,掌握金属活动性顺序是解题关键.

练习册系列答案
 学业测评一课一测系列答案
学业测评一课一测系列答案 小学课时作业全通练案系列答案
小学课时作业全通练案系列答案
相关题目
9.在实验操作考试时,某同学发现上个月做实验用的氢氧化钠溶液忘记了盖瓶盖.对于该溶液是否变质,同学们提出了如下假设:
【猜想】猜想一:没有变质;猜想二:部分变质;猜想三:全部变质.
【査阅资料】Na2C03溶液呈碱性.
【进行实验】对猜想二进行验证.
【反思】保存氢氧化钠溶液,必须注意密封.
【猜想】猜想一:没有变质;猜想二:部分变质;猜想三:全部变质.
【査阅资料】Na2C03溶液呈碱性.
【进行实验】对猜想二进行验证.
| 实验步骤 | 实验现象 | 结论 |
| 1.取少许该溶液于试管中,滴入适量的溶液. | 猜想二正确 | |
| 2.静置上述溶液,取上层清液少许于另一支试管中,滴入几滴溶液 |
13.溶液是一种重要的混合物,下列有关溶液的说法正确的是( )
| A. | 溶液具有均一性和稳定性,因为溶液中的各种粒子保持静止不动 | |
| B. | 饱和溶液是一定温度下不能再溶解该物质的溶液 | |
| C. | 不饱和溶液通过降低温度一定能变成饱和溶液 | |
| D. | 一种物质分散到另一种物质里一定能形成溶液 |


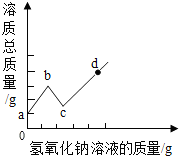 将某氢氧化钠溶液逐滴滴入硫酸和硫酸铜的混合溶液中,直至过量:根据实验事实绘制如图所示曲线,请回答:
将某氢氧化钠溶液逐滴滴入硫酸和硫酸铜的混合溶液中,直至过量:根据实验事实绘制如图所示曲线,请回答: