题目内容
6.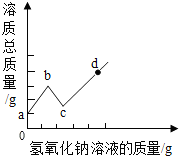 将某氢氧化钠溶液逐滴滴入硫酸和硫酸铜的混合溶液中,直至过量:根据实验事实绘制如图所示曲线,请回答:
将某氢氧化钠溶液逐滴滴入硫酸和硫酸铜的混合溶液中,直至过量:根据实验事实绘制如图所示曲线,请回答:(1)bc段对应的溶液,其溶质总质量下降的原因是加入NaOH(80份质量)小于生成沉淀Cu(OH)2(98份质量),所以溶质质量减小;
(2)c点对应的溶液中,溶质是硫酸钠;
(3)ab段和bc段(选填“ab段”、“bc段”、“ab段和bc段”或“cd段”)对应的溶液中,硫酸钠的质量逐渐增大.
分析 根据向一定量硫酸和硫酸铜的混合溶液中,逐滴加入一定质量分数的氢氧化钠溶液,直至过量,此过程在氢氧化钠先和硫酸反应,然后和硫酸铜反应进行分析.
解答 解:向一定量硫酸和硫酸铜的混合溶液中,逐滴加入一定质量分数的氢氧化钠溶液,直至过量,此过程在氢氧化钠先和硫酸反应,然后和硫酸铜反应,所以
(1)图中b→c线段对应CuSO4+2NaOH=Cu(OH)2↓+Na2SO4反应,由方程式可知加入NaOH(80份质量)小于生成沉淀Cu(OH)2(98份质量)所以溶质质量减小;
(2)c点时硫酸铜恰好完全反应,此时对应溶液中的溶质只有硫酸钠;
(3)通过分析图象中的数据可知,ab段是氢氧化钠和硫酸反应生成硫酸钠和水,bc段是氢氧化钠和硫酸铜反应生成硫酸钠和氢氧化铜沉淀,所以ab段和bc段对应的溶液中,硫酸钠的质量逐渐增大.
故答案为:(1)加入NaOH(80份质量)小于生成沉淀Cu(OH)2(98份质量),所以溶质质量减小;
(2)硫酸钠;
(3)ab段和bc段.
点评 解答本题的关键是要理解图象的物理意义和所代表的反应的反应原理和相关物质的定量反应关系,难度不大.

练习册系列答案
 英才点津系列答案
英才点津系列答案 红果子三级测试卷系列答案
红果子三级测试卷系列答案 课堂练加测系列答案
课堂练加测系列答案
相关题目
5.20℃时,向3个盛有50克水的烧杯中,分别加入一定质量的氯化钠,并充分溶解.根据下表实验数据回答.
(1)实验所得3杯溶液中,属于不饱和溶液的是A(选填编号).
(2)若将A杯中的溶液稀释成溶质的质量分数为0.9%的生理盐水,需加水941克.
| 实验编号 | A | B | C |
| 加入氯化钠的质量(克) | 9 | 18 | 27 |
| 溶液质量(克) | 59 | 68 | 68 |
(2)若将A杯中的溶液稀释成溶质的质量分数为0.9%的生理盐水,需加水941克.
11.南海、钓鱼岛及其附属海域是我国固有领土,蕴藏着丰富的海洋资源.
(1)海水制盐.从海水制取的粗盐中含有泥沙、硫酸镁和氯化钙等杂质.为得到较纯的氯化钠,将粗盐溶于水,然后进行如下操作:a.加过量的Ba(OH)2溶液;b.加稍过量的盐酸;c.加过量的Na2CO3溶液;d.过滤;e.蒸发.正确的操作顺序是acdbe(填字母).加Na2CO3溶液的作用是除去氯化钙和过量试剂氢氧化钡.
(2)海水淡化.图1是一个简易的蒸馏法淡化海水的装置.证明得到的水是淡水的最简便方法是蒸干后没有晶体析出.
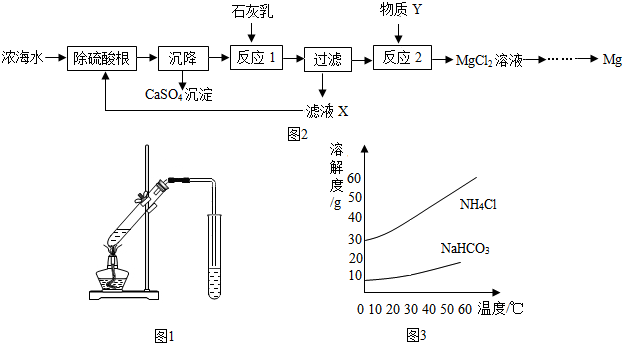
(3)海水制镁.浓海水中主要离子的浓度如上表.从浓海水中提取金属镁的一段工艺流程如图2所示:
写出反应1的化学方程式:Ca(OH)2+MgCl2=CaCl2+Mg(OH)2↓.滤液X中溶质的主要成分有CaCl2、NaCl(填化学式).将MgCl2溶液在一定条件下蒸发结晶、熔融电解可制得金属镁.则2L浓海水理论上可得到金属镁的质量为57.6g.
(4)海水“制碱”.氨碱法制纯碱是先向饱和食盐水通入氨气、二氧化碳生成NaHCO3和NH4Cl,NaHCO3结晶析出,再加热NaHCO3制得纯碱.写出生成NaHCO3和NH4Cl的化学方程式为NH3+CO2+NaCl+H2O=NaHCO3+NH4Cl;反应中生成NaHCO3和NH4Cl的质量比为84:53.5,NaHCO3和NH4Cl的溶解度曲线如图3所示.请分析NaHCO3结晶析出而NH4Cl没有结晶析出的原因是生成的NaHCO3质量比NH4Cl多而溶解度比NH4Cl小,先达到饱和.
(1)海水制盐.从海水制取的粗盐中含有泥沙、硫酸镁和氯化钙等杂质.为得到较纯的氯化钠,将粗盐溶于水,然后进行如下操作:a.加过量的Ba(OH)2溶液;b.加稍过量的盐酸;c.加过量的Na2CO3溶液;d.过滤;e.蒸发.正确的操作顺序是acdbe(填字母).加Na2CO3溶液的作用是除去氯化钙和过量试剂氢氧化钡.
| 离子 | Na+ | Mg2+ | Cl- | SO42- |
| 浓度/g/L | 63.7 | 28.8 | 144.6 | 46.4 |

(3)海水制镁.浓海水中主要离子的浓度如上表.从浓海水中提取金属镁的一段工艺流程如图2所示:
写出反应1的化学方程式:Ca(OH)2+MgCl2=CaCl2+Mg(OH)2↓.滤液X中溶质的主要成分有CaCl2、NaCl(填化学式).将MgCl2溶液在一定条件下蒸发结晶、熔融电解可制得金属镁.则2L浓海水理论上可得到金属镁的质量为57.6g.
(4)海水“制碱”.氨碱法制纯碱是先向饱和食盐水通入氨气、二氧化碳生成NaHCO3和NH4Cl,NaHCO3结晶析出,再加热NaHCO3制得纯碱.写出生成NaHCO3和NH4Cl的化学方程式为NH3+CO2+NaCl+H2O=NaHCO3+NH4Cl;反应中生成NaHCO3和NH4Cl的质量比为84:53.5,NaHCO3和NH4Cl的溶解度曲线如图3所示.请分析NaHCO3结晶析出而NH4Cl没有结晶析出的原因是生成的NaHCO3质量比NH4Cl多而溶解度比NH4Cl小,先达到饱和.
18.下列各组离子在水中能大量共存的是( )
| A. | Na+、H+、CO32- | B. | H+、K+、OH- | C. | H+、K+、SO42- | D. | Ag+、Ca2+、Cl- |