题目内容
某化工厂生产的纯碱产品中含有少量氯化钠杂质(其他杂质忽略不计),为测定该产品中含碳酸钠的质量分数,某课外兴趣小组进行了以下实验.取一定质量的该纯碱样品于试管中,加入85.6g稀盐酸,恰好完全反应,产生8.8g气体.将所得溶液蒸干后得到25.4g固体.请你据此分析计算:
(1)该产品中碳酸钠的质量分数是 .
(2)反应后所得溶液中溶质的质量分数.
(1)该产品中碳酸钠的质量分数是
(2)反应后所得溶液中溶质的质量分数.
考点:根据化学反应方程式的计算,有关溶质质量分数的简单计算
专题:溶质质量分数与化学方程式相结合的计算
分析:(1)可根据二氧化碳的质量,利用碳酸钠和盐酸反应的化学方程式进行计算.
(2)根据将所得溶液蒸干后得到固体的质量就是所得溶液中氯化钠的质量;
其次再根据第一问求出反应生成氯化钠的质量,求出原样品中氯化钠的质量;
最后求出溶液的总质量为反应前物质的质量减去放出气体的质量.进而求出质量分数.
(2)根据将所得溶液蒸干后得到固体的质量就是所得溶液中氯化钠的质量;
其次再根据第一问求出反应生成氯化钠的质量,求出原样品中氯化钠的质量;
最后求出溶液的总质量为反应前物质的质量减去放出气体的质量.进而求出质量分数.
解答:解:(1)设碳酸钠的质量为x,生成氯化钠的质量为y.
Na2 C03+2HCl=2NaCl+H20+C02↑
106 117 44
x y 8.8g
=
=
解之得:x=21.2g
解之得:y=23.4g
则原样品中NaCl的质量为:25.4g-23.4g=2.0g
原样品的质量为=21.2+2.0=23.2g
产品中碳酸钠的质量分数=
×100%=91.4%
(2)所得溶液的质量为:21.2g+2.0g+85.6g-8.8g=l00.0 g
所得溶液中溶质的质量分数为:
×100%=25.4%
答:(1)产品中碳酸钠的质量分数91.4%.
(2)所得溶液中溶质的质量分数为25.4%.
Na2 C03+2HCl=2NaCl+H20+C02↑
106 117 44
x y 8.8g
| 106 |
| x |
| 117 |
| y |
| 44 |
| 8.8g |
解之得:x=21.2g
解之得:y=23.4g
则原样品中NaCl的质量为:25.4g-23.4g=2.0g
原样品的质量为=21.2+2.0=23.2g
产品中碳酸钠的质量分数=
| 21.2g |
| 23.2g |
(2)所得溶液的质量为:21.2g+2.0g+85.6g-8.8g=l00.0 g
所得溶液中溶质的质量分数为:
| 25.4g |
| 100.0g |
答:(1)产品中碳酸钠的质量分数91.4%.
(2)所得溶液中溶质的质量分数为25.4%.
点评:本题有一定的难度,主要是原产品的质量,计算中用到了关系式解法和根据化学方程式进行求解,是一道不错的试题.

练习册系列答案
相关题目
科学家发现自然界中有三种碳原子,它们的核内质子数都是6,而中子数分别是6、7、8.下列关于它们的说法中正确的是( )
| A、它们属于不同种元素 |
| B、三种原子的质量相等 |
| C、它们的核外电子数不同 |
| D、不管含碳物质中到底含哪种碳原子,它们统称为碳元素 |
下列有关蜡烛的叙述错误的是( )
| A、蜡烛是无色、无味、透明的固体,不溶于水 |
| B、蜡烛浮于水面,说明它的密度比水小 |
| C、蜡烛在空气中燃烧有明亮的火焰,稍有黑烟,放出热量 |
| D、用指甲在蜡烛的表面轻轻一划,能出现纹迹,说明蜡烛的硬度较小 |
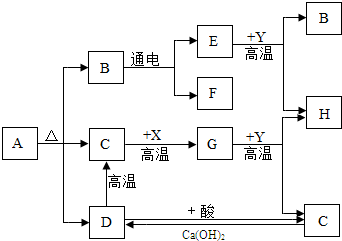 图中A、B、C、D、E、F、G、H分别代表相关反应的一种物质.已知:X、H为黑色固体单质,D是大理石的主要成分,Y为红棕色粉末.常温下C、E、F、G均为无色气体,图中有部分生成物未标出.请填写以下空白:
图中A、B、C、D、E、F、G、H分别代表相关反应的一种物质.已知:X、H为黑色固体单质,D是大理石的主要成分,Y为红棕色粉末.常温下C、E、F、G均为无色气体,图中有部分生成物未标出.请填写以下空白: