题目内容
9.比钠原子多一个质子少一个电子的粒子:Mg2+(写出粒子符号)分析 钠原子的核内质子数为11,核外电子数为11,比钠原子多一个质子少一个电子的粒子,质子数为12,电子数为10,为带2个单位正电荷的镁离子,进行分析解答.
解答 解:钠原子的核内质子数为11,核外电子数为11,比钠原子多一个质子少一个电子的粒子,质子数为12,电子数为10,为带2个单位正电荷的镁离子,其离子符号为:Mg2+.
故答案为:Mg2+.
点评 本题难度不大,明确比钠原子多一个质子少一个电子的粒子是镁离子是正确解答本题的关键.

练习册系列答案
 活力课时同步练习册系列答案
活力课时同步练习册系列答案
相关题目
19.下列实验操作(或方案)不能达到实验目的是( )
| 序号 | 实验操作(或方案) | 实验目的 |
| A | 取两块干燥的玻璃片,对着其中的一块哈气 | 比较呼出的气体和空气中水蒸气的含量 |
| B | 向试管中加入2mL浓氨水,将蘸有酚酞溶液的棉花靠近该试管的管口 | 证明分子在不断运动 |
| C | 把燃着的木条伸入充满氮气的集气瓶里 | 探究氮气是否支持燃烧 |
| D | 用排水法收集气体,当导管口有气泡放出时,立即将导管伸入盛满水的集气瓶中 | 收集纯净的气体 |
| A. | A | B. | B | C. | C | D. | D |
17.某实验小组对不同条件下的硝酸钾的溶解情况进行了以下实验. 在甲乙丙三个烧杯中放入20g硝酸钾晶体,再分别加入50.0g冷水、热水与酒精,充分搅拌后(保持各自的温度不变),结果如图所示.
(1)甲烧杯中溶液是饱和(填“饱和”或“不饱和”)溶液.
(2)由以上实验可得出结论:影响物质溶解度的因素有溶剂种类.
(3)将乙烧杯中的溶液降温到t1℃时,溶液恰好达到饱和状态.则t1℃时,硝酸钾的溶解度是40g/100g水.再往乙烧杯中加入10g水,改变温度至t2℃时,溶液又恰好达到饱和状态,则t1>t2(填“>”、“<”或“=”).分析上述数据,某温度时的硝酸钾溶解度数据可能存在较大的误差,该温度是50℃.

(1)甲烧杯中溶液是饱和(填“饱和”或“不饱和”)溶液.
(2)由以上实验可得出结论:影响物质溶解度的因素有溶剂种类.
(3)将乙烧杯中的溶液降温到t1℃时,溶液恰好达到饱和状态.则t1℃时,硝酸钾的溶解度是40g/100g水.再往乙烧杯中加入10g水,改变温度至t2℃时,溶液又恰好达到饱和状态,则t1>t2(填“>”、“<”或“=”).分析上述数据,某温度时的硝酸钾溶解度数据可能存在较大的误差,该温度是50℃.
| 温度/℃ | 0 | 20 | 40 | 50 | 60 | 80 |
| 溶解度/g | 13.3 | 31.6 | 63.9 | 145 | 110 | 169 |
14.2013年全国“两会”的重要议题之一是节约资源和保护环境.下列说法正确的是( )
①禁止使用农药和洗衣粉
②工业废水经处理达标后再排放
③抑制水中所有动植物的生长
④生活污水净化后再排放
⑤鼓励居民购买小汽车,方便出行
⑥研制高性能的耐磨轮胎,可减少细颗粒物(PM2.5)的产生
⑦用塑料制品代替木材,生产包装盒、快餐盒等,以减少木材的使用.
①禁止使用农药和洗衣粉
②工业废水经处理达标后再排放
③抑制水中所有动植物的生长
④生活污水净化后再排放
⑤鼓励居民购买小汽车,方便出行
⑥研制高性能的耐磨轮胎,可减少细颗粒物(PM2.5)的产生
⑦用塑料制品代替木材,生产包装盒、快餐盒等,以减少木材的使用.
| A. | ②④⑥ | B. | ①③⑦ | C. | ②④⑦ | D. | ④⑤⑥ |
1.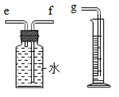 化学兴趣小组对“锌与稀硫酸反应快慢的影响因素”进行了探究.
化学兴趣小组对“锌与稀硫酸反应快慢的影响因素”进行了探究.
【提出问题】锌与稀硫酸反应的快慢受哪些因素的影响呢?
【猜想与假设】①可能与稀硫酸的溶质质量分数有关; ②可能与锌的形状有关.
【设计并实验】兴趣小组用100mL不同质量分数的稀硫酸和5g不同形状的锌进行如下实验(时间为3分钟).
(1)锌与硫酸反应的化学方程式为Zn+H2SO4=ZnSO4+H2↑.
(2)如图所示装置收集并测量氢气的体积,则正确的链接顺序是:氢气→e f g(填导管口序号).
【收集证据】
(3)要比较不同质量分数的硫酸对反应快慢的影响,应选择的实验编号是①③或②④.
【得出结论】依据上表得出的结论是相同条件下,硫酸的质量分数越大,反应速率越快或锌与硫酸的接触面积越大,反应速率越快.
【反思评价】
(4)下表是兴趣小组第①组实验根据前6分钟记录详细数据(每分钟记录一次产生氢气的体积).
请解释锌与稀硫酸反应由快变慢的原因随着硫酸被消耗,硫酸溶质质量分数变小,所以反应速度由快变慢.
(5)锌与硫酸反应的快慢可能还会受温度因素影响,如果用实验验证该因素对反应快慢的影响,应该控制温度因素不同,而其他因素则相同.
 化学兴趣小组对“锌与稀硫酸反应快慢的影响因素”进行了探究.
化学兴趣小组对“锌与稀硫酸反应快慢的影响因素”进行了探究.【提出问题】锌与稀硫酸反应的快慢受哪些因素的影响呢?
【猜想与假设】①可能与稀硫酸的溶质质量分数有关; ②可能与锌的形状有关.
【设计并实验】兴趣小组用100mL不同质量分数的稀硫酸和5g不同形状的锌进行如下实验(时间为3分钟).
| 编号 | 硫酸的质量分数 (均取20mL) | 锌的形状 (均取1g) | 氢气的体积(mL) (均收集3分钟) |
| 1 | 20% | 锌粒 | 31.7 |
| 2 | 20% | 锌片 | 50.9 |
| 3 | 30% | 锌粒 | 61.7 |
| 4 | 30% | 锌片 | 79.9 |
(2)如图所示装置收集并测量氢气的体积,则正确的链接顺序是:氢气→e f g(填导管口序号).
【收集证据】
(3)要比较不同质量分数的硫酸对反应快慢的影响,应选择的实验编号是①③或②④.
【得出结论】依据上表得出的结论是相同条件下,硫酸的质量分数越大,反应速率越快或锌与硫酸的接触面积越大,反应速率越快.
【反思评价】
(4)下表是兴趣小组第①组实验根据前6分钟记录详细数据(每分钟记录一次产生氢气的体积).
| 时段 (均为1分钟) | 第1分钟 | 第2分钟 | 第3分钟 | 第4分钟 | 第5分钟 | 第6分钟 |
| H2的体积/mL | 3.1 | 16.7 | 11.9 | 9.6 | 7.6 | 6.0 |
(5)锌与硫酸反应的快慢可能还会受温度因素影响,如果用实验验证该因素对反应快慢的影响,应该控制温度因素不同,而其他因素则相同.
 甲、乙、丙三种固体物质的溶解度曲线如图所示,请回答:
甲、乙、丙三种固体物质的溶解度曲线如图所示,请回答: