题目内容
采用适当的试剂,可从石灰石(主要成分是CaCO3)中获得高纯度CaCO3,其流程如图1:
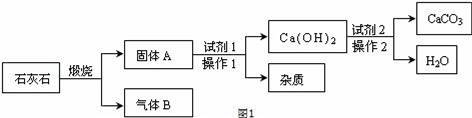

①流程图中进行的操作1、操作2的名称是 ;
②写出石灰石煅烧的化学方程式 ,该反应的基本反应类型是 .
③该流程图所示物质中,溶于水放出大量热的氧化物是 ,该物质与水反应的化学方程式为 2 .
④使原料中各原子的利用率尽可能达到100%是“绿色化学”的核心理念之一.上述流程中有的物质可以再利用,该流程中可循环利用的物质是 (填“化学式”).
【分析】①操作1、操作2都是将不溶于液体的固体和液体分离;
②石灰石经高温煅烧可制得氧化钙固体和二氧化碳气体,该反应是一种物质分解成为两种物质,符合分解反应类型;
③氧化钙溶于水放出热量,根据方程式的写法写出化学方程式;
④石灰石在分解反应中生成氧化钙和二氧化碳,二氧化碳在路线1中又可作为试剂使用,属于循环使用.
【解答】解:①操作1、操作2都是将不溶于液体的固体和液体分离,可以用过滤的方法;
②石灰石煅烧的反应物是碳酸钙,生成物是氧化钙和二氧化碳,二氧化碳后面标上上升符号,所以化学方程式为:CaCO3
 CaO+CO2↑,该反应是一种物质分解成为两种物质,符合分解反应类型;
CaO+CO2↑,该反应是一种物质分解成为两种物质,符合分解反应类型;
③氧化钙溶于水放出热量,反应物是氧化钙和水,生成物是氢氧化钙,所以方程式是:CaO+H2O═Ca(OH)2;
④由固体A和试剂1反应生成氢氧化钙,可知试剂1是水,在Ca(OH)2+CO2=CaCO3+H2O反应中水又是生成物,所以水可以循环使用,在上边的反应中,加入的试剂2为CO2,正是石灰石煅烧过程中产生的CO2气体,所以二氧化碳也可以循环利用.
故答案为:
①过滤;②CaCO3
 CaO+CO2↑;分解反应;③CaO(氧化钙);CaO+H2O═Ca(OH)2;④CO2、H2O.
CaO+CO2↑;分解反应;③CaO(氧化钙);CaO+H2O═Ca(OH)2;④CO2、H2O.

 小学课时特训系列答案
小学课时特训系列答案