题目内容
18.现有盐酸与氯化钙的混合溶液,为分析混合溶液中HCl和CaCl2的质量分数,设计如下实验方案: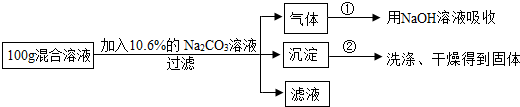
实验记录了两组数据:
第①组,气体吸收完全后,NaOH溶液质量增加4.4g.
第②组,沉淀完全后,经过滤、洗涤、干燥后称得固体质量10g.
根据实验设计及有关数据进行分析与计算:
(1)混合溶液中溶质HCl的质量为7.3g.
(2)混合溶液中CaCl2的质量分数(写出计算过程).
(3)请你画出该实验过程中加入Na2CO3溶液的质量与产生沉淀的质量的关系图.
分析 碳酸钠和稀盐酸反应生成氯化钠、水和二氧化碳,和氯化钙反应生成碳酸钙沉淀和氯化钠,根据反应的化学方程式和提供的数据可以进行相关方面的计算和判断.
解答 解:(1)设稀盐酸消耗碳酸钠的质量为x,混合溶液中溶质HCl的质量为y,
气体吸收完全后,NaOH溶液质量增加4.4g,说明反应生成了4.4g二氧化碳,
Na2CO3+2HCl=2NaCl+H2O+CO2↑,
106 73 44
x y 4.4g
$\frac{106}{x}$=$\frac{73}{y}$=$\frac{44}{4.4g}$,
x=10.6g,y=7.3g,
故填:7.3.
(2)设氯化钙质量为n,和氯化钙反应的碳酸钠质量为m,
Na2CO3+CaCl2═CaCO3↓+2NaCl,
106 111 100
m n 10g
$\frac{106}{m}$=$\frac{111}{n}$=$\frac{100}{10g}$,
m=10.6g,n=11.1g,
混合溶液中CaCl2的质量分数为:$\frac{11.1g}{100g}$×100%=11.1%,
答:混合溶液中CaCl2的质量分数为11.1%.
(3)碳酸钠和稀盐酸、氯化钙反应的质量相同,因此溶液质量也相同,和稀盐酸、氯化钙反应的碳酸钠溶液质量都为:10.6g÷10.6%=100g,该实验过程中加入Na2CO3溶液的质量与产生沉淀的质量的关系图如下所示:
点评 本题主要考查学生运用假设法和化学方程式进行计算和推断的能力,计算时要注意规范性和准确性.

| A. | 自然沉降 | B. | 煮沸 | C. | 过滤 | D. | 加活性炭 |
| 物质 | M | N | Q | P |
| 反应前质量(克) | 20 | 34 | 2 | 3 |
| 反应后质量(克) | X | 14 | 2 | 28 |
| A. | N是生成物 | B. | 反应后物质M的质量X等于5克 | ||
| C. | 物质Q可能是该反应的催化剂 | D. | 各物质之间已经完全反应 |
| A. | 燃烧时产生能量低于同质量的其他燃料 | |
| B. | 水资源受到严重污染,原料匮乏 | |
| C. | 氢气燃烧产物对环境有污染 | |
| D. | 制氢气耗能大,成本高 |



 如图为溴元素在元素周期表中的部分信息及溴原子的结构示意图,请回答:溴的相对原子质量为79.90;溴元素位于第四周期;溴化钠在医疗上可作镇定剂,溴化钠的化学式为NaBr.
如图为溴元素在元素周期表中的部分信息及溴原子的结构示意图,请回答:溴的相对原子质量为79.90;溴元素位于第四周期;溴化钠在医疗上可作镇定剂,溴化钠的化学式为NaBr.