题目内容
 化学兴趣小组的同学为了探究Mg、Fe、Cu的金属活动性展开了以下探究活动.
化学兴趣小组的同学为了探究Mg、Fe、Cu的金属活动性展开了以下探究活动.(1)设计方案并进行实验,获得结论.请你完成以下实验报告
| 实验方案 | 实验现象 | 实验结论 | |
| 步骤一 |  |
铁丝表面有红色物质 | 金属活动性:Fe > > Cu(填“<”或“>” |
| 步骤二 | 将Mg和Cu在酒精灯上点燃 | Mg Mg 能点燃,并发出耀眼强光,另一个不能点燃 |
金属活动性:Mg > > Cu(填“<”或“>” |
| 步骤三 |  5mL同种 稀硫酸(或稀盐酸) 稀硫酸(或稀盐酸) 溶液 |
一个产生气泡迅速,另一个产生气泡较慢 | 金属活动性:Mg > > Fe(填“<”或“>” |
小放提出步骤三的实验设计用“镁条、铁丝”不够严密,原因是反应的快慢与
接触面积
接触面积
有关.该步骤中,为了比较产生气泡的快慢,可以连接图,比较在相同时间内产生氢气的体积多少,则导管口c应连接a
a
(填“a”或“b”)陈梦认为以上实验方案不够简单,其实只用一种化合物的溶液(盐溶液)与另两种金属就能证明这三种金属的活动性,则这种化合物是
FeSO4
FeSO4
(填化学式).分析:(1)铁的金属性比铜强,铁可以置换出铜盐溶液中的铜;镁在空气中能燃烧而铜不能;镁和铁的金属性都在氢前,都能与酸反应,但镁的金属性比铁强,放出气泡较快.
(2)运用控制变量分析:镁条和铁丝与酸的接触面积不同对现象产生影响;进入量筒的水的体积就是收集到的氢气的体积,相同时间内收集的氢气越多产生氢气越快;利用金属和盐溶液发生置换反应的规律分析.
(2)运用控制变量分析:镁条和铁丝与酸的接触面积不同对现象产生影响;进入量筒的水的体积就是收集到的氢气的体积,相同时间内收集的氢气越多产生氢气越快;利用金属和盐溶液发生置换反应的规律分析.
解答:解:(1)方案一:铁可以置换出铜盐溶液中的铜,说明铁的金属性比铜强;
方案二:镁的金属活动性很强在空气中就能燃烧而铜不能,说明镁的金属性比铜强;
方案三:镁和铁的金属活动性都在氢前,都能与酸反应,但镁的活动性比铁强,放出气泡较快;
故答案为:>Mg>稀硫酸(或稀盐酸)>;
(2)镁条和铁丝与酸的接触面积不同,故会影响观察现象;因为氢气难溶于水,则氢气由b端通入,水由a端流出,a端连接c端水流入量筒内,进入量筒的水的体积就是收集到的氢气的体积,相同时间内收集的氢气越多产生氢气越快;利用金属和盐溶液发生置换反应:排在前面的金属能把排在后面的金属从其盐溶液中置换出来,故选择中间的铁的盐溶液,即 硫酸亚铁能和镁反应而不能和铜反应,说明镁的活动性最强,铜的活动性最弱.
故答案为:接触面积 a FeSO4 .
方案二:镁的金属活动性很强在空气中就能燃烧而铜不能,说明镁的金属性比铜强;
方案三:镁和铁的金属活动性都在氢前,都能与酸反应,但镁的活动性比铁强,放出气泡较快;
故答案为:>Mg>稀硫酸(或稀盐酸)>;
(2)镁条和铁丝与酸的接触面积不同,故会影响观察现象;因为氢气难溶于水,则氢气由b端通入,水由a端流出,a端连接c端水流入量筒内,进入量筒的水的体积就是收集到的氢气的体积,相同时间内收集的氢气越多产生氢气越快;利用金属和盐溶液发生置换反应:排在前面的金属能把排在后面的金属从其盐溶液中置换出来,故选择中间的铁的盐溶液,即 硫酸亚铁能和镁反应而不能和铜反应,说明镁的活动性最强,铜的活动性最弱.
故答案为:接触面积 a FeSO4 .
点评:本题考查学生对铜、铁、镁这三种物质的金属活动性顺序的比较,关键要理解金属与酸、与盐溶液发生反应的规律,并在此基础上灵活运用

练习册系列答案
 灵星计算小达人系列答案
灵星计算小达人系列答案 孟建平错题本系列答案
孟建平错题本系列答案
相关题目
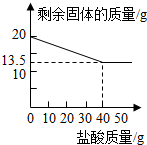 某化学兴趣小组的同学为测定假黄金(铜锌合金)组成元素的质量分数,称取20克假黄金置于烧杯中,用某浓度的稀盐酸50克,分5次加入,每次充分反应后,取出固体,经过滤、干燥等操作后称量,5次稀盐酸用量和剩余固体质量记录如下:
某化学兴趣小组的同学为测定假黄金(铜锌合金)组成元素的质量分数,称取20克假黄金置于烧杯中,用某浓度的稀盐酸50克,分5次加入,每次充分反应后,取出固体,经过滤、干燥等操作后称量,5次稀盐酸用量和剩余固体质量记录如下:| 实验次数 | 稀盐酸的用量(g) | 剩余固体的质量(g) |
| 1 | 10 | 18.375 |
| 2 | 10 | 16.750 |
| 3 | 10 | 15.125 |
| 4 | 10 | 13.500 |
| 5 | 10 | 13.500 |
(2)计算稀盐酸中溶质的质量分数;
(3)当合金中的锌与稀盐酸恰好完全反应时,所得溶液中溶质的质量分数为多少?
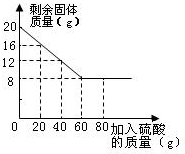 某化学兴趣小组的同学为测定Cu和CuO混合样品中CuO的含量,甲、乙、丙、丁四位同学均先称取20g样品于烧杯中,在分别加入20g、40g、60g、80g溶质质量分数相同的稀硫酸.充分反应后,均有固体剩余.经过滤、干燥后称量,剩余固体质量如下图所示.回答下列问题:
某化学兴趣小组的同学为测定Cu和CuO混合样品中CuO的含量,甲、乙、丙、丁四位同学均先称取20g样品于烧杯中,在分别加入20g、40g、60g、80g溶质质量分数相同的稀硫酸.充分反应后,均有固体剩余.经过滤、干燥后称量,剩余固体质量如下图所示.回答下列问题: