题目内容
9. 我国化工专家侯德榜曾为世界制碱工业作出了突出贡献.“侯氏制碱法”是以食盐、氨气、二氧化碳等为原料先制得NaHCO3,进而生产出纯碱.其生产过程用化学方程式可简要表示为:
我国化工专家侯德榜曾为世界制碱工业作出了突出贡献.“侯氏制碱法”是以食盐、氨气、二氧化碳等为原料先制得NaHCO3,进而生产出纯碱.其生产过程用化学方程式可简要表示为:①NH3+H2O+CO2=NH4HCO3;②NH4HCO3+NaCl=NaHCO3↓+NH4Cl;③2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑;
(1)“侯氏制碱法”生产过程中末涉及到的基本反应类型是A.
A.置换反应;B.化合反应;C.分解反应;D.复分解反应
(2)第②步中加入的是磨细的食盐粉,食盐磨细的目的是加快氯化钠的溶解速率.
若第②步中得到的NaHCO3中含有少量的NH4HCO3,但不会影响产品Na2CO3的纯度,原因是NH4HCO3$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O+CO2↑(用化学方程式表示).
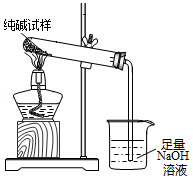
(3)若纯碱中含有NaHCO3杂质,为测定试样中纯碱的质量分数,用图中的装置进行实验.主要实验步骤如下:
用天平准确称量出干燥试管的质量为20.2克,然后称取4.0克已研碎的纯碱样品并放入干燥的试管中.用酒精灯加热,待充分反应并冷却后,在天平上称出试管和碳酸钠的质量23.5克.
①停止加热前,要进行的操作是把导管移出烧杯.
②该试样中纯碱的质量分数为52.5%.
分析 (1)根据反应物、生成物种类可以判断反应类型;
(2)氯化钠颗粒越小,溶解速率越快;
碳酸氢铵受热分解生成氨气、水和二氧化碳;
(3)为了防止液体倒流入试管,停止加热前,要进行的操作是把导管移出烧杯;
碳酸氢钠受热分解生成碳酸钠、水和二氧化碳,根据反应的化学方程式及其提供的数据可以进行相关方面的计算.
解答 解:(1)①NH3+H2O+CO2=NH4HCO3,属于化合反应;
②NH4HCO3+NaCl=NaHCO3↓+NH4Cl,属于复分解反应;
③2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑,属于分解反应,因此“侯氏制碱法”生产过程中末涉及到的基本反应类型是置换反应.
故填:A.
(2)第②步中加入的是磨细的食盐粉,食盐磨细的目的是加快氯化钠的溶解速率;
若第②步中得到的NaHCO3中含有少量的NH4HCO3,但不会影响产品Na2CO3的纯度,原因是:碳酸氢铵受热分解生成氨气、水和二氧化碳,反应的化学方程式为:NH4HCO3$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O+CO2↑.
故填:加快氯化钠的溶解速率;NH4HCO3$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O+CO2↑.
(3)若纯碱中含有NaHCO3杂质,为测定试样中纯碱的质量分数,用图中的装置进行实验.主要实验步骤如下:
用天平准确称量出干燥试管的质量为20.2克,然后称取4.0克已研碎的纯碱样品并放入干燥的试管中.用酒精灯加热,待充分反应并冷却后,在天平上称出试管和碳酸钠的质量23.5克.
①停止加热前,要进行的操作是把导管移出烧杯.
故填:把导管移出烧杯.
②设碳酸氢钠质量为x,
2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑,固体质量差
168 106 168-106=62
x 20.2g+4.0g-23.5g=0.7g
$\frac{168}{x}$=$\frac{62}{0.7g}$,
x=1.9g,
该试样中纯碱的质量分数为:$\frac{4.0g-1.9g}{4.0g}$×100%=52.5%,
故填:52.5%.
点评 本题主要考查学生运用假设法和化学方程式进行计算和推断的能力,计算时要注意规范性和准确性.

| A. | Cu(OH)2能使酚酞试液变红色 | B. | Cu(OH)2能与CO2反应生成CuCO3和H2O | ||
| C. | Cu(OH)2能与盐酸反应 | D. | Cu(OH)2能与BaCl2反应生成盐和碱 |
| A. | 滴入适量 AgNO3溶液和稀硝酸,观察到有白色沉淀 | |
| B. | 滴入适量 FeCl3溶液,溶液变黄,但无沉淀生成 | |
| C. | 滴入几滴酚酞试液,酚酞试液不变色 | |
| D. | 测得反应后溶液中 Na+与 Cl-的个数比为 1:1 |

| A. | 物质a中混有少量b物质,应采用冷却热饱和溶液的方法进行提纯 | |
| B. | 在温度高于80℃时,a物质的溶解度大于b物质的溶解度 | |
| C. | 在37℃时,将20克a物质放入50克水中,充分溶解后得到的溶液,其溶质质量分数为23.1% | |
| D. | 分别将a、b两物质的饱和溶液从60℃降至37℃,析出晶体(不含结晶水)较多的是a |
①水是由氧气和氢气组成的;
②水是生物生存所需的最基本的物质;
③水通常以固、液、气三态存在;
④在实验室中,水是最常用的溶剂;
⑤纯净的水是没有气味、没有味道、没有颜色的液体;
⑥纯净的水洁净、透明、稳定,是一种溶液.
| A. | ①②③④⑤ | B. | ①②③⑥ | C. | ②③④⑤ | D. | ②③④⑤⑥ |
| A. | 石蜡受热熔化属于化学变化 | B. | 木炭燃烧属于物理变化 | ||
| C. | 水银的熔点低属于物理性质 | D. | 金刚石的硬度大属于化学性质 |




 某课外兴趣小组的同学,通过实验测定铁与稀硫酸反应的有关数据,并绘制了如图的函数图象,其中横坐标表示时间,纵坐标可以表示:A.反应时溶液的质量,B.反应时生成氢气的质量,C.反应时溶液的密度,D.反应时溶液的导电性,其中正确的是A.
某课外兴趣小组的同学,通过实验测定铁与稀硫酸反应的有关数据,并绘制了如图的函数图象,其中横坐标表示时间,纵坐标可以表示:A.反应时溶液的质量,B.反应时生成氢气的质量,C.反应时溶液的密度,D.反应时溶液的导电性,其中正确的是A.
 ①水在天然循环过程中实现了水的自身净化
①水在天然循环过程中实现了水的自身净化