题目内容
12. 我校化学兴趣小组同学为了测定石灰石中碳酸钙的质量分数,将15g石灰石样品加入到73g稀盐酸中恰好完全反应(杂质不溶于水,也不与盐酸反应),产生CO2气体的情况如图所示.计算:
我校化学兴趣小组同学为了测定石灰石中碳酸钙的质量分数,将15g石灰石样品加入到73g稀盐酸中恰好完全反应(杂质不溶于水,也不与盐酸反应),产生CO2气体的情况如图所示.计算:(1)石灰石样品中碳酸钙的质量分数是66.7%.(计算结果保留0.1%)
(2)所用稀盐酸中溶质质量分数是10%.
(3)反应后所得溶液中氯化钙的溶质质量分数是多少?(写出计算过程,计算结果保留0.1%)
分析 (1)根据反应曲线图,充分反应放出二氧化碳的质量为4.4g,用反应的化学方程式,由生成二氧化碳的质量计算样品中碳酸钙的质量,碳酸钙质量与样品质量比即为样品中碳酸钙含量;
(2)由放出二氧化碳的质量,利用反应的化学方程式,计算出恰好完全时所加73g稀盐酸中溶质质量,再使用溶质质量分数公式计算出所用稀盐酸的质量分数;
(3)根据二氧化碳的质量可求出生成的氯化钙的质量,所得溶液的质量=反应前各组份的质量之和-气体的质量-杂质的质量,并据溶质的质量分数解答.
解答 解:设样品中CaCO3的质量为x,参加反应的稀盐酸中HCl的质量为y,生成氯化钙得知量为z
CaCO3+2HCl=CaCl2+CO2↑+H2O
100 73 111 44
x y z 4.4g
$\frac{100}{x}=\frac{73}{y}=\frac{111}{z}=\frac{44}{4.4g}$
x=10g,y=7.3g,z=11.1g
(1)样品中CaCO3的质量分数为:$\frac{10g}{15g}$×100%≈66.7%;
(2)该稀盐酸中溶质的质量分数是:$\frac{7.3g}{73g}$×100%=10%;
(3)恰好完全反应后所得溶液的质量是:10g+73g-4.4g=78.6g;
反应完全后溶液中溶质的质量分数是:$\frac{11.1g}{78.6g}$×100%=14.1%
答:(1)66.7%;
(2)10%;
(3)反应完全后溶液中溶质的质量分数是14.1%.
点评 本题考查了根据溶质质量分数公式以及反应的化学方程式的计算,完成此题,可以依据已有的知识进行.在对数形结合类问题中的表示变化的曲线进行分析时,曲线的折点的特殊意义是分析的重点.


| A. | 氧化钙和水 | B. | 硝酸铵和水 | C. | 氯化钠和水 | D. | 石灰石和稀盐酸 |
| A. |  当心爆炸 | B. |  严禁烟火 | C. |  节能标志 | D. |  绿色食品 |
| A. | 2H | B. | Fe | C. | N | D. | O2 |
| A. | CO(NH2)2 | B. | NH4H2PO4 | C. | KCl | D. | Ca3(PO4)2 |
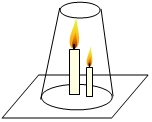 对“高低不同的燃着的蜡烛罩上玻璃杯后,谁先熄灭?”这一问题,甲、乙两同学有不同的认识:甲同学认为高的蜡烛先熄灭,乙同学认为低的蜡烛先熄灭.他们设计了如图所示的实验来验证自己的猜想.
对“高低不同的燃着的蜡烛罩上玻璃杯后,谁先熄灭?”这一问题,甲、乙两同学有不同的认识:甲同学认为高的蜡烛先熄灭,乙同学认为低的蜡烛先熄灭.他们设计了如图所示的实验来验证自己的猜想. 我国矿产资源丰富,铟的生产规模较大.图1是元素周期表中铟元素的信息,图2是铟原子的结构示意图.回答下列问题.
我国矿产资源丰富,铟的生产规模较大.图1是元素周期表中铟元素的信息,图2是铟原子的结构示意图.回答下列问题.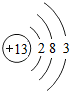 ,该元素与铟元素在元素周期上处于同一个族.
,该元素与铟元素在元素周期上处于同一个族.