题目内容
12.向硝酸亚铁和硝酸银的混合溶液中加入一定量的锌粉和铜粉,充分反应后过滤,滤液呈蓝色,则滤液中一定含有的金属离子有Cu2+、Fe2+、Zn2+(填离子符号)分析 根据充分反应后过滤,滤液呈蓝色,说明溶液一定含有铜离子,铜已经开始反应,说明锌已经完全反应,而溶液中有铜离子存在,说明固体中没有铁,那么溶液中一定含有亚铁离子进行解答.
解答 解:由于四种金属的活动性顺序是:锌>铁>铜>银,由题意可知,充分反应后过滤,滤液呈蓝色,说明溶液一定含有铜离子,铜已经开始反应,说明锌已经完全反应,而溶液中有铜离子存在,说明固体中没有铁,那么溶液中一定含有亚铁离子,所以滤液中一定含有的金属离子有Zn2+、Fe2+、Cu2+.
故答为:Cu2+、Fe2+、Zn2+.
点评 本题主要考查了金属活动性顺序表的应用,完成此题,可以依据题干提供的信息,结合已有的知识进行.

练习册系列答案
相关题目
2.有一包白色粉末,可能含有氯化钡、氢氧化钠、氯化钠、碳酸钠、硫酸钠、硫酸铜中的一种或几种.为确定其组成,进行下列实验:
①将该白色粉末溶于足量的水中,产生白色沉淀和无色溶液,过滤;
②将滤液分成二等份,向一份中滴加酚酞试液,溶液变红;向另一份中滴加硝酸银溶液,溶液变浑浊;
③将滤渣投入足量的稀盐酸中,白色固体部分溶解并产生大量无色无味的气体.
则下列说法不正确的是( )
①将该白色粉末溶于足量的水中,产生白色沉淀和无色溶液,过滤;
②将滤液分成二等份,向一份中滴加酚酞试液,溶液变红;向另一份中滴加硝酸银溶液,溶液变浑浊;
③将滤渣投入足量的稀盐酸中,白色固体部分溶解并产生大量无色无味的气体.
则下列说法不正确的是( )
| A. | 白色粉末中肯定没有硫酸铜,可能有氢氧化钠和氯化钠 | |
| B. | 白色粉末中肯定有氯化钡、氢氧化钠、硫酸钠和碳酸钠 | |
| C. | 白色粉末中肯定有氯化钡、硫酸钠和碳酸钠,可能有氢氧化钠和氯化钠 | |
| D. | 若在滤液中滴加稀盐酸产生气泡,则白色粉末中肯定有碳酸钠和氯化钡,且二者的质量比可能为$\frac{{m(N{a_2}C{O_3})}}{{m(BaC{l_2})}}$>$\frac{106}{208}$ |
7.将物质分类是学习化学的一种重要的方法,下列各组物质中,前者属于纯净物,后者属于混合物的是( )
| A. | 纯净的空气、冰水混合物 | B. | 液氧、自来水 | ||
| C. | 碘酒、食醋 | D. | 干冰、高锰酸钾 |
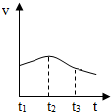 以下是甲、乙两同学对有关镁与盐酸反应的系列研究.
以下是甲、乙两同学对有关镁与盐酸反应的系列研究.