题目内容
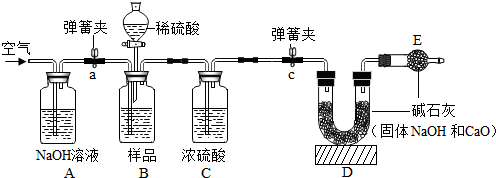
工业生产的氢氧化钠常含有碳酸钠杂质.为测定某样品中氢氧化钠纯度,设计以下实验.(装置气密性良好,每一步骤反应完全,浓H2SO4具有吸水性)
【实验设计】
主要步骤如下,请填空:
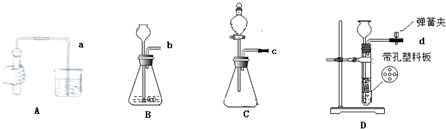
①按图组装仪器,并检查 ;
②将10g试样放入B瓶中,加适量蒸馏水溶解,得到试样溶液;
③打开弹簧夹a,先对装置A、B、C(已连接)通入空气一会儿,以排尽装置含有的 ,再关闭弹簧夹a,接上装置D和E,打开弹簧夹c,
④从分液漏斗中滴入20%的稀硫酸,直到 为止,写出反应的化学方程式: ;
⑤反应结束后,待装置冷却后直接称量装置 (填字母序号)质量.
【数据分析】
⑥根据该装置在反应前后的质量差得到CO2的质量1.1g,由此计算出该样品中碳酸钠的质量为 g,最后得到样品中氢氧化钠纯度为 %;
【实验反思】
⑦装置中浓硫酸的作用是 ,没有E的装置其结果偏 .
⑧分液漏斗中的稀H2SO4不能换成浓盐酸,理由是 .
⑨若用生成沉淀的方法来测定试样中纯碱的质量分数,应选用的试剂是 .
⑩最后计算得到样品中氢氧化钠纯度比实际数据偏大,反思整个实验过程,造成误差可能的原因: .
【实验设计】

主要步骤如下,请填空:
①按图组装仪器,并检查
②将10g试样放入B瓶中,加适量蒸馏水溶解,得到试样溶液;
③打开弹簧夹a,先对装置A、B、C(已连接)通入空气一会儿,以排尽装置含有的
④从分液漏斗中滴入20%的稀硫酸,直到
⑤反应结束后,待装置冷却后直接称量装置
【数据分析】
⑥根据该装置在反应前后的质量差得到CO2的质量1.1g,由此计算出该样品中碳酸钠的质量为
【实验反思】
⑦装置中浓硫酸的作用是
⑧分液漏斗中的稀H2SO4不能换成浓盐酸,理由是
⑨若用生成沉淀的方法来测定试样中纯碱的质量分数,应选用的试剂是
⑩最后计算得到样品中氢氧化钠纯度比实际数据偏大,反思整个实验过程,造成误差可能的原因:
考点:实验探究物质的组成成分以及含量,气体的净化(除杂),盐的化学性质,书写化学方程式、文字表达式、电离方程式
专题:科学探究
分析:【实验设计】因为该反应中有气体参与,所以要检查装置的气密性;空气中含有二氧化碳,在实验过程中应给与除掉;测定含量,需碳酸钠完全反应;称量吸收二氧化碳的装置质量;
【数据分析】根据二氧化碳的质量,利用化学方程式进行计算;
【实验反思】根据浓硫酸具有吸水性来分析;装置E中可以防止空气中的二氧化碳和水蒸气进入;盐酸具有挥发性;选择可以与碳酸钠反应生成沉淀的物质;根据质量守恒定律可知装置D中反应前后的质量差就是产生CO2的质量进行解答.
【数据分析】根据二氧化碳的质量,利用化学方程式进行计算;
【实验反思】根据浓硫酸具有吸水性来分析;装置E中可以防止空气中的二氧化碳和水蒸气进入;盐酸具有挥发性;选择可以与碳酸钠反应生成沉淀的物质;根据质量守恒定律可知装置D中反应前后的质量差就是产生CO2的质量进行解答.
解答:解:【实验设计】①连接装置,检查装置的气密性;故填:装置气密性;
③通入的空气被A中的氢氧化钠溶液吸收,并且该空气将装置内原有空气排净,目的是排出二氧化碳的干扰;故填:二氧化碳;
④向样品中滴加稀硫酸直到不再产生气泡为止,说明碳酸钠完全参与反应,故填:不再产生气泡;Na2CO3+H2SO4=Na2SO4+H2O+CO2↑;
⑤产生的二氧化碳被C干燥后,完全被D中的碱石灰吸收,则碱石灰增加的质量即为生成二氧化碳的质量;故填:D;
【数据分析】⑥设碳酸钠的质量为x,则
Na2CO3+H2SO4=Na2SO4+H2O+CO2↑
106 44
x 1.1g
=
x=2.65g
样品中氢氧化钠纯度为
×100%=73.5%.
故答案为:2.65;73.5%;
【实验反思】⑦浓硫酸对生成的二氧化碳起到了干燥作用;E中的碱石灰可以防止空气中的水蒸气和二氧化碳对实验数据形成干扰,若没有,D增重偏大,导致氢氧化钠的纯度偏小;故填:干燥二氧化碳;小;
⑧浓盐酸具有挥发性,对实验数据造成影响;故填:浓盐酸具有强烈的挥发性;
⑨碳酸钠能与氯化钙溶液反应生成碳酸钙白色沉淀,进而加以分析计算;故填:氯化钙溶液;
⑩由质量守恒定律可知装置D中反应前后的质量差就是产生CO2的质量,如果B、C装置和导气管中CO2没有被D碱石灰吸收,计算得到样品中氢氧化钠纯度比实际数据偏大.
故填:B、C装置和导气管中CO2没有被D碱石灰吸收.
③通入的空气被A中的氢氧化钠溶液吸收,并且该空气将装置内原有空气排净,目的是排出二氧化碳的干扰;故填:二氧化碳;
④向样品中滴加稀硫酸直到不再产生气泡为止,说明碳酸钠完全参与反应,故填:不再产生气泡;Na2CO3+H2SO4=Na2SO4+H2O+CO2↑;
⑤产生的二氧化碳被C干燥后,完全被D中的碱石灰吸收,则碱石灰增加的质量即为生成二氧化碳的质量;故填:D;
【数据分析】⑥设碳酸钠的质量为x,则
Na2CO3+H2SO4=Na2SO4+H2O+CO2↑
106 44
x 1.1g
| 106 |
| 44 |
| x |
| 1.1g |
x=2.65g
样品中氢氧化钠纯度为
| 10g-2.65g |
| 10g |
故答案为:2.65;73.5%;
【实验反思】⑦浓硫酸对生成的二氧化碳起到了干燥作用;E中的碱石灰可以防止空气中的水蒸气和二氧化碳对实验数据形成干扰,若没有,D增重偏大,导致氢氧化钠的纯度偏小;故填:干燥二氧化碳;小;
⑧浓盐酸具有挥发性,对实验数据造成影响;故填:浓盐酸具有强烈的挥发性;
⑨碳酸钠能与氯化钙溶液反应生成碳酸钙白色沉淀,进而加以分析计算;故填:氯化钙溶液;
⑩由质量守恒定律可知装置D中反应前后的质量差就是产生CO2的质量,如果B、C装置和导气管中CO2没有被D碱石灰吸收,计算得到样品中氢氧化钠纯度比实际数据偏大.
故填:B、C装置和导气管中CO2没有被D碱石灰吸收.
点评:本题将计算和实验有机地结合起来进行考查,通过认真审题,结合题干中已给出一系列的提示,根据提出的问题,发现有用的信息,充分发挥联想,与已有的知识建立联系,然后进行类比推导,从而达到解决问题的目的.

练习册系列答案
相关题目
下列物质中,铁元素质量分数最大的是( )
| A、FeO |
| B、Fe2O3 |
| C、Fe3O4 |
| D、FeSO4 |