题目内容
14.金属镍(Ni)与物质X的溶液发生反应的化学方程式为:Ni+X═Cu+NiSO4,则下列说法错误的是( )| A. | Ni的化合价由0变为+2价 | B. | X的化学式为CuSO4 | ||
| C. | 反应后固体质量增加 | D. | Cu的金属活动性比Ni强 |
分析 根据已有的知识进行分析,位置在前的金属能将位于其后的金属从其盐溶液中置换出来,根据质量守恒定律进行推测X的化学式.
解答 解:A、因为Ni→NiSO4,则Ni的化合价由0变为+2,故说法正确;
B、金属镍(Ni)与物质X的溶液发生反应的化学方程式为:Ni+X═Cu+NiSO4,根据质量守恒定律进行推测X的化学式为CuSO4,故说法正确;
C、生成的铜的质量大于参加反应的镍的质量,因此反应后固体质量增加,故说法正确;
D、根据Ni+X═Cu+NiSO4,则可知Cu的金属活动性比Ni弱,故说法错误;
故选D.
点评 本题考查了金属活动性顺序和质量守恒定律的应用,完成此题,可以依据金属活动性顺序及其意义进行.

练习册系列答案
 浙大优学小学年级衔接捷径浙江大学出版社系列答案
浙大优学小学年级衔接捷径浙江大学出版社系列答案
相关题目
2.可用同一化学原理解释的现象是( )
①向澄清石灰水中,通过吸管不断吹入人体呼出的气体,石灰水变浑浊;
②久置的石灰水,液面上出现一层硬壳状薄膜;
③为了使石灰浆刷过的墙壁快点晾干,在室内生起一盆炭 火,开始时墙壁更潮湿;
④向蓝色硫酸铜溶液中放入铁钉,溶液变色.
①向澄清石灰水中,通过吸管不断吹入人体呼出的气体,石灰水变浑浊;
②久置的石灰水,液面上出现一层硬壳状薄膜;
③为了使石灰浆刷过的墙壁快点晾干,在室内生起一盆炭 火,开始时墙壁更潮湿;
④向蓝色硫酸铜溶液中放入铁钉,溶液变色.
| A. | ①②③ | B. | ①②④ | C. | ①③④ | D. | ②③④ |
3.下列生活中的变化,不属于化学变化的是( )
| A. | 酒精挥发 | B. | 汽油燃烧 | C. | 牛奶变馊 | D. | 烧碱潮解 |
9.下列说法错误的是( )
| A. | 水变成水蒸气,分子体积增大了 | |
| B. | 分子、原子、离子都可以构成物质 | |
| C. | 保持水的化学性质的最小粒子是水分子 | |
| D. | 原子的质量主要集中在原子核上 |
19.科学学习小组围绕“酸碱中和反应”,在老师引导下开展探究活动.
【演示实验】将一定量的稀H2SO4加入到盛有NaOH溶液的小烧杯中.
【提出问题】实验中未观察到明显现象,部分同学产生了疑问:反应后溶液中溶质是什么呢?
【假设猜想】针对疑问,大家纷纷提出猜想.猜想如下:
猜想一:只有Na2SO4 猜想二:有Na2SO4和H2SO4 猜想三:有Na2SO4和NaOH
【实验探究】取烧杯中的溶液少量于试管中,滴加几滴CuSO4溶液,无明显变化,溶液中一定没有氢氧化钠.学习小组利用烧杯中的溶液,并选用老师提供的pH试纸、铁丝、BaCl2溶液、Na2CO3溶液,进行如下三个方案的探究.
【评价反思】老师对同学们能用多种方法进行探究,并且得出正确结论给予肯定.同时指出
【实验探究】中存在两处明显错误,同学们经过反思发现了这两处错误:
(1)实验操作中的错误是pH试纸浸入溶液中.
(2)实验方案中也有一个是错误,应如何改进取待测样品,加入铁丝,有气泡产生,证明溶液中含有稀硫酸.
【演示实验】将一定量的稀H2SO4加入到盛有NaOH溶液的小烧杯中.
【提出问题】实验中未观察到明显现象,部分同学产生了疑问:反应后溶液中溶质是什么呢?
【假设猜想】针对疑问,大家纷纷提出猜想.猜想如下:
猜想一:只有Na2SO4 猜想二:有Na2SO4和H2SO4 猜想三:有Na2SO4和NaOH
【实验探究】取烧杯中的溶液少量于试管中,滴加几滴CuSO4溶液,无明显变化,溶液中一定没有氢氧化钠.学习小组利用烧杯中的溶液,并选用老师提供的pH试纸、铁丝、BaCl2溶液、Na2CO3溶液,进行如下三个方案的探究.
| 实验方案 | 测溶液pH | 滴加Na2CO3溶液 | 滴加BaC12溶液 |
| 实验操作 | 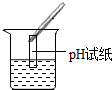 | 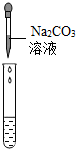 | 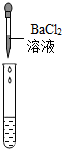 |
| 实验现象 | 试纸变色,对比比色卡,pH<7 | 有气泡产生 | 产生白色沉淀 |
| 实验结论 | 溶液中有H2SO4 | 溶液中有H2SO4 | 溶液中有H2SO4 |
【实验探究】中存在两处明显错误,同学们经过反思发现了这两处错误:
(1)实验操作中的错误是pH试纸浸入溶液中.
(2)实验方案中也有一个是错误,应如何改进取待测样品,加入铁丝,有气泡产生,证明溶液中含有稀硫酸.
6. 相同质量的M、N两种金属,分别与相同质量分数的足量稀盐酸反应(M、N在生成物中均为+2价),生成氢气质量和反应时间的关系如图所示,则下列说法错误的是( )
相同质量的M、N两种金属,分别与相同质量分数的足量稀盐酸反应(M、N在生成物中均为+2价),生成氢气质量和反应时间的关系如图所示,则下列说法错误的是( )
 相同质量的M、N两种金属,分别与相同质量分数的足量稀盐酸反应(M、N在生成物中均为+2价),生成氢气质量和反应时间的关系如图所示,则下列说法错误的是( )
相同质量的M、N两种金属,分别与相同质量分数的足量稀盐酸反应(M、N在生成物中均为+2价),生成氢气质量和反应时间的关系如图所示,则下列说法错误的是( )| A. | 生成氢气质量:M>N | B. | 金属活动强弱:M<N | ||
| C. | 相对原子质量:M>N | D. | 消耗盐酸质量:M>N |
4.如表列举的是通常状况下除去混合物中所含杂质的方法,其中正确的是( )
| 编号 | 物质(括号内为杂质) | 所加试剂 | 操作方法 |
| A | CuSO4粉末(Fe粉) | 水 | 搅拌、过滤、将滤液蒸发结晶 |
| B | KCl(KClO3) | 少量MnO2 | 加热 |
| C | FeSO4溶液(H2SO4) | 足量Fe粉 | 搅拌、过滤 |
| D | CO2(CO) | 足量O2 | 点燃 |
| A. | A | B. | B | C. | C | D. | D |
 M是生活中常见的金属,MSO4溶液是无色液体,某化学兴趣小组的同学欲探究M与铜、铝的活动性顺序,请你和他们一起进行以下探究活动.
M是生活中常见的金属,MSO4溶液是无色液体,某化学兴趣小组的同学欲探究M与铜、铝的活动性顺序,请你和他们一起进行以下探究活动. 回答下列问题:
回答下列问题: