题目内容
 某化学兴趣小组的同学在综合实践活动中了解到,某石灰石原料,其中只含有的一种杂质是二氧化硅(二氧化硅不溶于水,不能与盐酸反应,高温下不发生分解反应).为了测定该石灰石的纯度,兴趣小组取用2g这种石灰石样品,用实验室现有的稀盐酸30g分次加入,充分反应后,经过滤、干燥等操作后称量,每次稀盐酸用量及剩余固体的质量见下表(利用实验数据绘制的图象如图所示)
某化学兴趣小组的同学在综合实践活动中了解到,某石灰石原料,其中只含有的一种杂质是二氧化硅(二氧化硅不溶于水,不能与盐酸反应,高温下不发生分解反应).为了测定该石灰石的纯度,兴趣小组取用2g这种石灰石样品,用实验室现有的稀盐酸30g分次加入,充分反应后,经过滤、干燥等操作后称量,每次稀盐酸用量及剩余固体的质量见下表(利用实验数据绘制的图象如图所示) | 稀盐酸的用量 | 剩余固体的质量 |
| 第一次加入5g | 1.5g |
| 第二次加入5g | 1.0g |
| 第三次加入5g | 0.5g |
| 第四次加入5g | 0.3g |
| 第五次加入5g | 0.3g |
(1)该石灰石样品的纯度是
(2)如果该石灰石厂煅烧50t这种石灰石,最多可得到含杂质的生石灰多少吨?
考点:根据化学反应方程式的计算
专题:综合计算(图像型、表格型、情景型计算题)
分析:由于第1、2、3次加入5g稀盐酸时固体的质量都是减少了0.5g,说明5g稀盐酸恰好能够和0.5g碳酸钙完全反应,即5g稀盐酸最多能和0.5g碳酸钙反应,而第4次再加入5g稀盐酸时固体只减少了0.2g,说明固体中的碳酸钙已经全部参与反应,剩余的0.3g固体不能和稀盐酸反应,即石灰石样品中杂质是0.3g,碳酸钙的质量是(2g-0.3g)=1.7g.根据质量分数计算公式便可计算出石灰石的纯度(石灰石中碳酸钙的质量分数).然后根据化学方程式和碳酸钙的质量(石灰石的质量乘以其纯度)就可求出制取的二氧化碳的质量.
解答:解:(1)根据表格和图象可知:第1、2、3次盐酸全部反应,碳酸钙有剩余;第4次中盐酸已经有剩余,碳酸钙已经完全反应,杂质是0.3g;
碳酸钙的质量=2g-0.3g=1.7g,石灰石样品的纯度=
×100%=85%.
(2)设生成二氧化碳的质量为x,
CaCO3
CaO+CO2↑
100 44
50t×85% x
=
x=18.7t
含杂质的生石灰为50t-18.7t=31.3t
故答案为:(1)85%;(2)答:含杂质的生石灰为31.3t.
碳酸钙的质量=2g-0.3g=1.7g,石灰石样品的纯度=
| 1.7g |
| 2g |
(2)设生成二氧化碳的质量为x,
CaCO3
| ||
100 44
50t×85% x
| 100 |
| 50t×85% |
| 44 |
| x |
x=18.7t
含杂质的生石灰为50t-18.7t=31.3t
故答案为:(1)85%;(2)答:含杂质的生石灰为31.3t.
点评:本题难度不是很大,主要考查了如何根据图象去分析数据及根据化学方程式的计算,培养学生分析数据的能力和解决问题的能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目

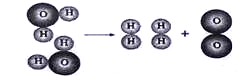 下图是水分子在一定条件下分解的示意图,从中获得的信息正确的是
下图是水分子在一定条件下分解的示意图,从中获得的信息正确的是