题目内容
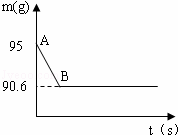
鸡蛋壳的主要成分是碳酸钙.某兴趣小组为了测定鸡蛋壳中CaCO3的含量,现取15g鸡蛋壳,捣碎,放在烧杯中,然后向其中加入80g某浓度的稀盐酸,使之充分反应(鸡蛋壳中除CaCO3外的其他成分都不溶于水,且不与稀盐酸反应),测得烧杯中的反应剩余物的质量(m)与反应时间(t)的关系如图所示(忽略水蒸气的挥发),其中当反应进行到B点时,所用盐酸刚好消耗了加入量的一半.试计算(计算结果保留1位小数):
(1)产生CO2的质量为 g;
(2)该鸡蛋壳中CaCO3的质量分数.
(3)所用稀盐酸中溶质的质量分数.
| 根据化学反应方程式的计算;有关溶质质量分数的简单计算;质量守恒定律及其应用.. | |
| 专题: | 压轴实验题;溶液的组成及溶质质量分数的计算;有关化学方程式的计算. |
| 分析: | (1)碳酸钙与盐酸反应生成氯化钙、水和二氧化碳,生成的二氧化碳扩散到空气中,烧杯中前后减少的质量即为二氧化碳的质量. (2)根据二氧化碳的质量求出碳酸钙的质量,再根据 (3)根据二氧化碳的质量求出一半稀盐酸中溶质的质量,再根据 |
| 解答: | 解:(1)产生CO2的质量为:95g﹣90.6g=4.4g 故答案为:4.4g (2)设鸡蛋壳中碳酸钙的质量为x,一半稀盐酸中溶质的质量为y. CaCO3+2HCl=CaCl2+H2O+CO2↑ 100 73 44 x y 4.4g
(3)稀盐酸中溶质的质量分数= |
| 点评: | 石灰石与稀盐酸反应,反应前后减少的质量为二氧化碳的质量,固体在反应前后减少的质量为参加反应的碳酸钙的质量,要将两者区分清. |

 中考解读考点精练系列答案
中考解读考点精练系列答案 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案 ×100%求出鸡蛋壳中碳酸钙的质量分数.
×100%求出鸡蛋壳中碳酸钙的质量分数. ×100%求出稀盐酸中溶质的质量分数.
×100%求出稀盐酸中溶质的质量分数. ,x=10g
,x=10g ,y=7.3g
,y=7.3g ×100%=66.7% 答:鸡蛋壳中碳酸钙的质量分数为66.7%.
×100%=66.7% 答:鸡蛋壳中碳酸钙的质量分数为66.7%. ×100%≈18.3% 答:稀盐酸中溶质的质量分数为18.3%.
×100%≈18.3% 答:稀盐酸中溶质的质量分数为18.3%. __;
__;
 、后的说法正确的是:
、后的说法正确的是: A.均为混合物 B.质量减少
A.均为混合物 B.质量减少