题目内容
14.将15克石灰石放入烧杯中,加入50克的稀盐酸,恰好完全反应,反应后剩余物质的质量为60.6克(杂质不溶与水,也不参与反应).计算:(1)生成二氧化碳的质量?
(2)反应前稀盐酸溶质的质量分数?
分析 (1)碳酸钙与盐酸反应只放出一种气体二氧化碳使反应前后质量出现差异,所以使用质量守恒定律,可由反应前后质量差计算出生成二氧化碳的质量;
(2)根据反应放出二氧化碳的质量,根结合化学方程式计算参加反应的盐酸的质量,盐酸质量与样品的质量比可计算稀盐酸的质量分数.
解答 解:(1)根据质量守恒定律,恰好完全反应后生成二氧化碳的质量为:50g+15g-60.6g=4.4g;
(2)设参加反应的盐酸质量为x
CaCO3+2HCl=CaCl2+H2O+CO2↑
73 44
x 4.4g
$\frac{73}{x}$=$\frac{44}{4.4g}$
x=7.3g
稀盐酸的质量分数:$\frac{7.3g}{50g}$×100%=14.6%
故答案为:(1)4.4g;
(2)14.6%.
点评 根据反应的化学方程式可以表示反应中各物质的质量比,由反应中任一物质的质量可计算出反应中其它物质的质量.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
1.某校化学兴趣小组的同学在探究酸碱中和反应时,将一定量的稀H2SO4加入到盛有NaOH溶液的小烧杯中,反应的化学方程式是:H2SO4+2NaOH═Na2SO4 +2H2O.未观察到明显现象,部分同学对实验产生了疑问:反应后溶液中溶质是什么呢?
【提出猜想】针对疑问,小明同学作出如下猜想:
猜想一:只有Na2SO4 猜想二:有Na2SO4和H2SO4
猜想三:有Na2SO4和NaOH 猜想四:有Na2SO4、H2SO4和NaOH
小华同学对以上猜想提出质疑,认为有一种猜想是不合理的.不合理的是猜想四.
【实验探究】同学们对剩余的猜想进行了探究:
(1)取烧杯中的溶液少量于试管中,滴加几滴CuSO4溶液,无明显变化,溶液中一定没有NaOH.
(2)为了验证其余猜想,学习小组的同学设计了三套实验方案:
【实验结论】经过实验探究,大家一致认为猜想二是正确的.
【实验反思】写出方案一的化学方程式:Na2CO3+H2SO4=Na2SO4+H2O+CO2↑.
三个方案中有一个方案是错误的,原因是BaCl2与Na2SO4反应也会生成白色沉淀,不能证明一定有H2SO4存在.
【提出猜想】针对疑问,小明同学作出如下猜想:
猜想一:只有Na2SO4 猜想二:有Na2SO4和H2SO4
猜想三:有Na2SO4和NaOH 猜想四:有Na2SO4、H2SO4和NaOH
小华同学对以上猜想提出质疑,认为有一种猜想是不合理的.不合理的是猜想四.
【实验探究】同学们对剩余的猜想进行了探究:
(1)取烧杯中的溶液少量于试管中,滴加几滴CuSO4溶液,无明显变化,溶液中一定没有NaOH.
(2)为了验证其余猜想,学习小组的同学设计了三套实验方案:
| 实验方案 | 取少量烧杯中溶液 | 实验现象 | 实验结论 |
| 方案一 | 加入Na2CO3溶液 | 有气泡产生 | 溶液中有H2SO4 |
| 方案二 | 滴加紫色石蕊溶液 | 溶液变红 | 溶液中有H2SO4 |
| 方案三 | 加入BaC12溶液 | 有白色沉淀生成 | 溶液中有H2SO4 |
【实验反思】写出方案一的化学方程式:Na2CO3+H2SO4=Na2SO4+H2O+CO2↑.
三个方案中有一个方案是错误的,原因是BaCl2与Na2SO4反应也会生成白色沉淀,不能证明一定有H2SO4存在.
18.我校学生进行了如图所示的实验.

(1)甲实验中滴加稀盐酸后,可观察到的现象是溶液变无色,证明两者确实发生了反应.
(2)乙实验中反应的方程式CO2+2NaOH═Na2CO3+H2O.
(3)丙实验中试管内有白色沉淀产生.
(4)实验结束后,同学们将甲、乙、丙三个实验的废液倒人同一个干净的废液缸中,最终看到废液浑浊并呈红色,由此说明废液中含有碳酸钙,一定不含有盐酸.
【提出问题】废液中究竟含有哪些物质?
【交流讨论】
①一定含有的物质:碳酸钙、指示剂、水和氯化钠.
②还含有能使废液呈碱性的物质.能使废液呈碱性的物质是什么?同学们有如下猜想.
小方认为:只有碳酸钠
小丽认为:只有氢氧化钙
小云认为:是氢氧化钠和碳酸钠
小新认为:只有氢氧化钠
你认为还可能是:氢氧化钠和氢氧化钙.
【实验设计】小斌想用氯化钙溶液来验证小方的猜想.查阅资料获悉氯化钙溶液呈中性,并设计如下实验.请你将小斌的实验设计补充完整.
【反思拓展】在分析化学反应后所得物质的成分时,除了考虑生成物外还需考虑反应物是否有剩余.

(1)甲实验中滴加稀盐酸后,可观察到的现象是溶液变无色,证明两者确实发生了反应.
(2)乙实验中反应的方程式CO2+2NaOH═Na2CO3+H2O.
(3)丙实验中试管内有白色沉淀产生.
(4)实验结束后,同学们将甲、乙、丙三个实验的废液倒人同一个干净的废液缸中,最终看到废液浑浊并呈红色,由此说明废液中含有碳酸钙,一定不含有盐酸.
【提出问题】废液中究竟含有哪些物质?
【交流讨论】
①一定含有的物质:碳酸钙、指示剂、水和氯化钠.
②还含有能使废液呈碱性的物质.能使废液呈碱性的物质是什么?同学们有如下猜想.
小方认为:只有碳酸钠
小丽认为:只有氢氧化钙
小云认为:是氢氧化钠和碳酸钠
小新认为:只有氢氧化钠
你认为还可能是:氢氧化钠和氢氧化钙.
【实验设计】小斌想用氯化钙溶液来验证小方的猜想.查阅资料获悉氯化钙溶液呈中性,并设计如下实验.请你将小斌的实验设计补充完整.
| 实验内容 | 预计现象 | 预计结论 |
| 取少量废液缸中上层清液于试管中,加入过量氯化钙溶液,静置. | 小方的猜想正确. |
 现有①木炭②硫黄③红磷④铝箔⑤蜡烛,五种物质分别在氧气中燃烧,用序号
现有①木炭②硫黄③红磷④铝箔⑤蜡烛,五种物质分别在氧气中燃烧,用序号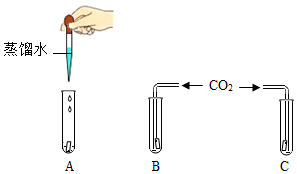 为证明CO2能与水反应,设计了如图所示的实验,图中A、B、C分别为用石蕊溶液染成的紫色干燥的滤纸,分析回答问题
为证明CO2能与水反应,设计了如图所示的实验,图中A、B、C分别为用石蕊溶液染成的紫色干燥的滤纸,分析回答问题