题目内容
2. 某补钙剂说明书的部分信息如图所示.小明对该补钙剂十分感兴趣,取10片钙片放入100g稀盐酸中,有效成分刚好完全反应(其他成分不与盐酸反应),剩余固体和液体总质量比反应前减少了2.2g,发生反应的化学方程式为:CaCO3+2HCl═CaCl2+H2O+CO2↑.请完成下列问题:
某补钙剂说明书的部分信息如图所示.小明对该补钙剂十分感兴趣,取10片钙片放入100g稀盐酸中,有效成分刚好完全反应(其他成分不与盐酸反应),剩余固体和液体总质量比反应前减少了2.2g,发生反应的化学方程式为:CaCO3+2HCl═CaCl2+H2O+CO2↑.请完成下列问题:(1)反应生成了二氧化碳气体2.2g;
(2)10片钙片中CaCO3的质量是多少g?(写出计算过程).
分析 根据题干提供的信息结合标签进行分析,混合物减少的质量就是生成的二氧化碳的质量,根据二氧化碳的质量结合反应的化学方程式就可以求出碳酸钙的质量,据此解答.
解答 解:(1)混合物减少的质量就是生成的二氧化碳的质量,所以生成的二氧化碳的质量是2.2g;
(2)设钙片中CaCO3的质量是x,
CaCO3+2HCl═CaCl2+H2O+CO2↑
100 44
x 2.2g
$\frac{100}{x}$=$\frac{44}{2.2g}$
x=5g
答:钙片中CaCO3的质量是5g.
故答案为:(1)2.2;
(2)5g.
点评 本题考查了根据化学方程式的计算,完成此题,可以依据已有的知识进行.

练习册系列答案
相关题目
7. 若取相同质量的铝、镁、锌和铁四种金属中任意三种分别跟盐酸反应,情况如图所示,依图回答:图中的曲线说明三种金属的质量(每种金属的质量为m克)和盐酸溶质的质量(n 克)之间的关系是 或 .(用不等式表示)
若取相同质量的铝、镁、锌和铁四种金属中任意三种分别跟盐酸反应,情况如图所示,依图回答:图中的曲线说明三种金属的质量(每种金属的质量为m克)和盐酸溶质的质量(n 克)之间的关系是 或 .(用不等式表示)
 若取相同质量的铝、镁、锌和铁四种金属中任意三种分别跟盐酸反应,情况如图所示,依图回答:图中的曲线说明三种金属的质量(每种金属的质量为m克)和盐酸溶质的质量(n 克)之间的关系是 或 .(用不等式表示)
若取相同质量的铝、镁、锌和铁四种金属中任意三种分别跟盐酸反应,情况如图所示,依图回答:图中的曲线说明三种金属的质量(每种金属的质量为m克)和盐酸溶质的质量(n 克)之间的关系是 或 .(用不等式表示)| A. | 65n/73≤m 或56n/73≤m | B. | 65n/73≤m 或56n/73≤m | ||
| C. | 65n/73≤m 或56n/73≥m | D. | 65n/73≥m 或56n/73≥m |
14.某校科学兴趣小组为测定某硝酸铵样品的纯度,将10g样品溶于30g水后,再加入13.7g氢氧化钠浓溶液共热,两者恰好完全反应(硝酸铵中的杂质不与氢氧化钠反应,也不溶于水,硝酸铵与氢氧化钠的反应方程式为:NH4NO3+NaOH△NaNO3+H2O+NH3↑).把产生的所有NH3用足量的硫酸溶液完全吸收,同时测量2分钟内硫酸溶液增加的质量,结果如下表所示:
试回答下列问题:
(1)由表中数据分析可知,硝酸铵与氢氧化钠反应所产生的NH3的速率是
先快后慢(选填:均匀的、先快后慢或先慢后快).
(2)表中m可能为C.(填选号)
A.0.8 B.0.9 C.1.0 D.1.1
(3)硝酸铵样品的纯度为多少?
| 时 间/s | 0 | 20 | 30 | 40 | 60 | 80 | 100 | 120 |
| 增加的质量/g | 0 | 0.7 | m | 1.2 | 1.5 | 1.6 | 1.7 | 1.7 |
(1)由表中数据分析可知,硝酸铵与氢氧化钠反应所产生的NH3的速率是
先快后慢(选填:均匀的、先快后慢或先慢后快).
(2)表中m可能为C.(填选号)
A.0.8 B.0.9 C.1.0 D.1.1
(3)硝酸铵样品的纯度为多少?
14.人类每时每刻都离不开空气.空气成分按体积计,氧气约占( )
| A. | 78% | B. | 21% | C. | 50% | D. | 1% |
11.有关分子、原子的说法不正确的是( )
| A. | 氮分子是保持氮气化学性质的最小粒子 | |
| B. | 化学变化中分子可分、而原子不可分 | |
| C. | 分子能构成物质,而原子不能 | |
| D. | 原子是化学变化中的最小粒子 |
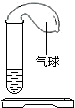 如图所示,开始在气球中装有某种固体,在试管中装有某种液体,实验之前,气球是瘪的.实验时,把气球中的固体倒入试管中,发现气球慢慢变大.请你预测该固体和液体药品.(提示:可以填物质的化学式,也可以填物质的名称)
如图所示,开始在气球中装有某种固体,在试管中装有某种液体,实验之前,气球是瘪的.实验时,把气球中的固体倒入试管中,发现气球慢慢变大.请你预测该固体和液体药品.(提示:可以填物质的化学式,也可以填物质的名称) 如图为A、B两种不含结晶水的固体的溶解度曲线:
如图为A、B两种不含结晶水的固体的溶解度曲线: