题目内容
13. 化学兴趣小组用下图所示装置研究两个问题(夹持装置已略去).
化学兴趣小组用下图所示装置研究两个问题(夹持装置已略去).(1)研究燃烧的条件
【步骤1】向C中加入少量白磷,再加入热水,塞好胶塞,使导管口浸入热水中,白磷不燃烧.
【步骤2】打开K1,关闭K2,将A中溶液滴入B中,C中有气泡冒出,白磷燃烧.
B中发生反应的化学方程式为2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑.此实验运用对比的方法研究了燃烧的一个条件,它是燃烧需要氧气.
(2)研究二氧化碳与氢氧化钠的反应:A中盛有稀硫酸,B中盛有碳酸钠固体,C中盛有氢氧化钠固体.
【实验1】打开K1,关闭K2,将A中溶液滴入B中,现象:气球变大.打开K2,关闭K1,一段时间后,气球没有明显变瘪.
实验1没有出现预期的实验现象,改进后重新加入药品进行了实验2.
【实验2】打开K2,关闭K1,将A中溶液滴入B中,用燃着的木条放在K2上方的导管口处,木条熄灭.上述实验操作的目的是排出装置中的空气,并验证生成的气体是二氧化碳.
分析 (1)根据物质燃烧的条件可知,将A中的溶液滴入B中,C中有气泡冒出,白磷燃烧,说明生成的气体是氧气,据此写出化学反应式;
(2)根据二氧化碳不支持燃烧的特点分析操作目的;证明生产的气体二氧化碳减少了,就说明二氧化碳与氢氧化钠反应了.
解答 解:(1)B中应是过氧化氢溶液和二氧化锰在常温下反应生成水和氧气,反应的方程式为:2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑;C管内的白磷具备燃烧的条件:具有可燃性,温度达到了白磷的着火点,通入氧气后白磷燃烧,未通氧气时白磷不燃烧,通过对比探究出燃烧需要氧气的条件;
(2)步骤1中打开K1,关闭K2,将A中溶液滴入B中,气球变大,打开K2,关闭K1,一段时间后气球没有明显变瘪,说明气球内还有气体没有与氢氧化钠反应,不能说明CO2与NaOH固体的反应.
所以进行改进后,继续实验.实验1中气球没有明显变瘪,应该是装置中的空气不与氢氧化钠反应的结果.
所以进行实验2时,打开K2,关闭K1,将A中液体滴入B中,用燃着的木条放在K2上,发现木条熄灭.这样做的目的一则是排出装置中的空气,二则验证生成的气体是二氧化碳.
故答案为:(1)2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑、燃烧需要氧气;(2)排出装置中的空气,并验证生成的气体是二氧化碳.
点评 本题实验设计新颖,考查了燃烧的条件和化学反应方程式的书写、以及二氧化碳的性质,需要同学们在学好基础知识的基础上,结合具体题目情景灵活运用知识分析解答.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
3.如图所示的标志中,属于我国塑料包装制品回收标志的是( )
| A. |  | B. |  | C. |  | D. |  |
4.从环境保护的角度考虑,下列燃料最理想的是( )
| A. | 煤 | B. | 氢气 | C. | 可燃冰 | D. | 石油 |
1.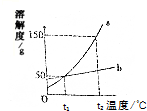 如图是a、b两种固体物质(不含结晶冰)的溶解度曲线,下列叙述错误的是( )
如图是a、b两种固体物质(不含结晶冰)的溶解度曲线,下列叙述错误的是( )
 如图是a、b两种固体物质(不含结晶冰)的溶解度曲线,下列叙述错误的是( )
如图是a、b两种固体物质(不含结晶冰)的溶解度曲线,下列叙述错误的是( )| A. | t2℃时,a的溶解度大于b的溶解度 | |
| B. | t2℃时,a的饱和溶液的溶质的质量分数为t1℃时的3倍 | |
| C. | b中含有少量a,可以用恒温蒸发溶剂的方法提纯b | |
| D. | t1℃时,等质量的a、b两种物质的饱和溶液中溶质质量一定相等 |
4.肥皂水呈弱碱性,则肥皂水的pH可能是( )
| A. | 9.5 | B. | 7.0 | C. | 5.6 | D. | 1.2 |
1.下列分析正确的是( )
| A. | 铁钉浸入硫酸铜溶液中,铁钉变红,铁没有铜活泼 | |
| B. | 氢气通入灼热的氧化铜粉末中,红色粉末变黑,氢气具有还原性 | |
| C. | 向汗液中滴入硝酸银溶液和稀硝酸,产生白色沉淀,汗液中含有氯离子 | |
| D. | 纯碱与盐酸混合,有气泡产生,纯碱与盐酸发生中和反应 |
2.下列实验现象描述不正确的是( )
| A. | 电解水时正极产生的气体的体积比负极产生的气体体积多 | |
| B. | 硫在空气中燃烧,产生淡蓝色火焰 | |
| C. | 细铁丝在氧气中剧烈燃烧,火星四射,生成黑色固体 | |
| D. | 铜绿受热分解,固体由绿色变为黑色 |
 右图为甲、乙、丙三种不含结晶水的固体物质的溶解度曲线
右图为甲、乙、丙三种不含结晶水的固体物质的溶解度曲线