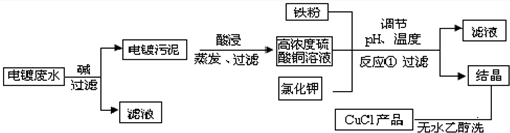
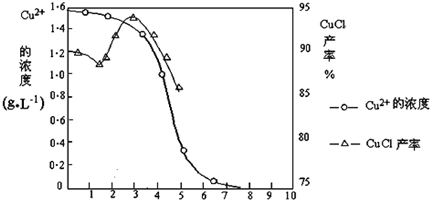
题目内容
| |||||||||||
答案:
解析:
解析:
(1) |
红磷 |
(2) |
瓶内充满白烟,①燃烧匙内红磷有剩余,瓶内空气中的氧气全部被消耗,②水流入瓶内且约占瓶容积的1/5,氧气约占空气总体积的1/5 |

练习册系列答案
相关题目
下图是铁丝在氧气中燃烧的实验流程图.请回答下列问题:

(1)实验时夹取细铁丝的仪器叫 ,要先把铁丝弯成螺旋状的原因是
(2)张欢实验时,集气瓶炸裂了,请你帮助他分析一下可能的原因 .
(3)铁丝在空气中和在纯氧气中反应情况不同,说明化学反应除与温度、压强、催化剂等条件有关外,还与 有关.
(4)金属铁能在氧气中剧烈燃烧,张欢对“铁丝在氧气中燃烧为什么会火星四射”进行如下探究.下表是他将纯镁条和不同含碳量的铁丝(镁条和铁丝直径均为0.4mm)放入氧气中燃烧时的实验现象记录.请你帮助分析回答:
①铁在氧气中燃烧的化学反应的文字表达式为 ;
②你认为表中“未填”的实验现象是 ;
③分析上述实验现象,你认为造成铁丝在氧气中燃烧时现象不同的主要原因可能是 .

(1)实验时夹取细铁丝的仪器叫
(2)张欢实验时,集气瓶炸裂了,请你帮助他分析一下可能的原因
(3)铁丝在空气中和在纯氧气中反应情况不同,说明化学反应除与温度、压强、催化剂等条件有关外,还与
(4)金属铁能在氧气中剧烈燃烧,张欢对“铁丝在氧气中燃烧为什么会火星四射”进行如下探究.下表是他将纯镁条和不同含碳量的铁丝(镁条和铁丝直径均为0.4mm)放入氧气中燃烧时的实验现象记录.请你帮助分析回答:
| 镁条 | 含碳0.05%的铁丝 | 含碳0.2%的铁丝 | 含碳0.6%的铁丝 | |
| 燃烧时的现象 | 剧烈燃烧,发出耀眼白光,无火星 | 剧烈燃烧极少火星 | 剧烈燃烧少量火星 | (未填) |
②你认为表中“未填”的实验现象是
③分析上述实验现象,你认为造成铁丝在氧气中燃烧时现象不同的主要原因可能是


 (2011?阜新)空气是一种人类宝贵的自然资源.
(2011?阜新)空气是一种人类宝贵的自然资源.