题目内容
5.氢氧化钴[Co(OH)2]可作涂料和油漆的干燥剂,其制备方法是:把金属钴与稀盐酸反应制得氯化钴(CoCl2),再将氯化钴溶液与氢氧化钠溶液反应制得氢氧化钴.查阅资料:氯化钴溶液是粉红色,氢氧化钴是难溶于水的粉红色固体.请回答:(1)预测金属钴与稀盐酸反应的现象金属逐渐溶解,表面有气泡产生,溶液由无色变成粉红色.
(2)氯化钴溶液与氢氧化钠溶液反应的化学方程式是CoCl2+2NaOH=Co(OH)2↓+2NaCl.
(3)下列说法正确的是AC.
A.钴的金属活动性比铜的强
B.氢氧化钴不能与盐酸反应
C.氯化钴溶液也能和石灰水反应.
分析 (1)根据题意,金属钴与稀盐酸反应制得氯化钴(CoCl2),说明金属钴能与稀盐酸反应,氯化钴溶液是粉红色的,据此进行分析解答.
(2)氯化钴溶液与氢氧化钠溶液反应生成氢氧化钴沉淀和氯化钠,写出反应的化学方程式即可.
(3)由金属钴能与稀盐酸反应,结合复分解反应发生的条件,进行分析解答.
解答 解:(1)金属钴与稀盐酸反应制得氯化钴(CoCl2),说明金属钴能与稀盐酸反应,会观察到金属逐渐溶解,表面有气泡产生,溶液由无色变成粉红色.
(2)氯化钴溶液与氢氧化钠溶液反应生成氢氧化钴沉淀和氯化钠,反应的化学方程式为:CoCl2+2NaOH=Co(OH)2↓+2NaCl.
(3)A.金属钴能与稀盐酸反应,说明钴的金属活动性比铜的强,故选项说法正确.
B.氢氧化钴属于碱,氢氧化钴能与盐酸发生中和反应,故选项说法错误,
C.氯化钴溶液能和石灰水反应生成氢氧化钴沉淀和氯化钙,故选项说法正确.
故答案为:(1)金属逐渐溶解,表面有气泡产生,溶液由无色变成粉红色;(2)CoCl2+2NaOH=Co(OH)2↓+2NaCl;(3)AC.
点评 本题难度不大,掌握金属的化学性质、碱的化学性质、化学方程式的书写方法是正确解答本题的关键.

练习册系列答案
相关题目
4.下列元素中,属于金属元素的是( )
| A. | Cl | B. | Ar | C. | Mn | D. | Si |
20.下列关于碳及碳的氧化物的说法不正确的是( )
| A. | 活性炭可吸附水中的色素 | |
| B. | 用闻气味的方法能够区别CO2和CO | |
| C. | CO可以在氧气中燃烧 | |
| D. | CO2可作为大棚种植农作物的气体肥料 |
10.探究Ca(OH)2的溶解性.
【猜想】
猜想一:Ca(OH)2不溶于水; 猜想二:Ca(OH)2易溶于水; 猜想三:Ca(OH)2微溶于水.
【实验】
取一小药匙Ca(OH)2粉末,放入小烧杯中,加入30ml水,用玻璃棒搅拌后,观察到烧杯中出现白色浑浊.
【结论】根据上述实验中观察到的烧杯中有白色浑浊(填现象),判断猜想二不成立.
【查阅资料】Ca(OH)2微溶于水.
【实验设计验证】请设计两种不同的实验方案证明Ca(OH)2微溶于水.
提供的试剂有:稀盐酸,碳酸钠溶液,二氧化碳气体.
【猜想】
猜想一:Ca(OH)2不溶于水; 猜想二:Ca(OH)2易溶于水; 猜想三:Ca(OH)2微溶于水.
【实验】
取一小药匙Ca(OH)2粉末,放入小烧杯中,加入30ml水,用玻璃棒搅拌后,观察到烧杯中出现白色浑浊.
【结论】根据上述实验中观察到的烧杯中有白色浑浊(填现象),判断猜想二不成立.
【查阅资料】Ca(OH)2微溶于水.
【实验设计验证】请设计两种不同的实验方案证明Ca(OH)2微溶于水.
| 方案 | 实验操作 | 实验现象 | 实验结论 |
| 1 | Ca(OH)2微溶于水. | ||
| 2 |
17.室温时,不饱和的食盐水在空气中露置一段时间后,有少量晶体析出.对此下列说法不正确的是( )
| A. | 溶液的质量减小 | B. | 溶质的质量减小 | ||
| C. | 溶质的质量分数减小 | D. | 溶液变成饱和溶液 |
15.如图是某反应的微观示意图,下列说法不正确的是( )
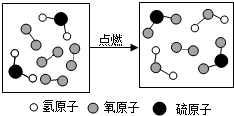

| A. | 反应物中有化合物 | |
| B. | 该反应为置换反应 | |
| C. | 生成物的分子个数比为1:1 | |
| D. | 参加反应的  和 和  的质量比为17:24 的质量比为17:24 |
 酸碱可以发生中和反应,生成盐和水,如图是硫酸溶液和氢氧化钠溶液反应过程中溶液的pH变化,请写出从图中获取的信息:
酸碱可以发生中和反应,生成盐和水,如图是硫酸溶液和氢氧化钠溶液反应过程中溶液的pH变化,请写出从图中获取的信息: 在做完“用稀盐酸和石灰石反应制取二氧化碳”的实验后,小明突然想到:是否可以测得实验所用的石灰石中碳酸钙的含量呢?小明又进行了如下实验:①将试管中反应的剩余物过滤并多次用蒸馏水洗涤,得到滤液和滤渣.②向滤渣中滴加稀盐酸,无明显的现象.③将滤渣干燥后称量,质量为0.5g.④向滤液中加入10%的Na2CO3溶液,获得了相关的数据,并绘制成如图所示的图象.根据小明的实验过程回答下列问题(假设石灰石中的其余杂质不与稀盐酸反应)
在做完“用稀盐酸和石灰石反应制取二氧化碳”的实验后,小明突然想到:是否可以测得实验所用的石灰石中碳酸钙的含量呢?小明又进行了如下实验:①将试管中反应的剩余物过滤并多次用蒸馏水洗涤,得到滤液和滤渣.②向滤渣中滴加稀盐酸,无明显的现象.③将滤渣干燥后称量,质量为0.5g.④向滤液中加入10%的Na2CO3溶液,获得了相关的数据,并绘制成如图所示的图象.根据小明的实验过程回答下列问题(假设石灰石中的其余杂质不与稀盐酸反应)