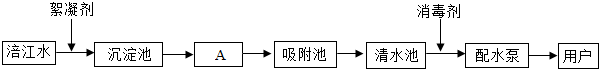
题目内容
1.生活中处处都要用到科学知识.(1)在家庭里,常可以选用厨房用品中的食醋(选填“黄酒”、“苏打”、“食盐”或“食醋”)来除去铁制品表面的锈迹.
(2)久置的铜制品表面常有一些铜锈,铜锈的主要成分是碱式碳酸铜[Cu2(OH)2CO3].铜生锈除了与氧气、水有关外,从碱式碳酸铜的化学式的推知还与空气中的二氧化碳有关.
(3)胃酸过多容易引发胃溃疡,生活中,可用少量苏打来减少胃酸,请写出苏打与胃酸反应的化学方程式Na2CO3+2HCl=2NaCl+H2O+CO2↑.
分析 (1)根据食醋能和铁锈反应进行解答;
(2)根据质量守恒定律可知,化学反应前后元素的种类不变进行解答;
(3)根据胃酸的主要成分是盐酸,苏打的主要成分是碳酸钠,盐酸和碳酸钠反应生成氯化钠、水和二氧化碳进行解答.
解答 解:(1)食醋能和铁锈反应,所以可用食醋来除去铁制品表面的锈迹;
(2)根据质量守恒定律可知,化学反应前后元素的种类不变,由铜锈的主要成分是碱式碳酸铜[Cu2(OH)2CO3]可知,碱式碳酸铜中含有碳元素,所以铜生锈除了与氧气、水有关外,从碱式碳酸铜的化学式的推知还与空气中的二氧化碳有关;
(3)胃酸的主要成分是盐酸,苏打的主要成分是碳酸钠,盐酸和碳酸钠反应生成氯化钠、水和二氧化碳,反应的化学方程式为Na2CO3+2HCl=2NaCl+H2O+CO2↑.
故答案为:(1)食醋;(2)二氧化碳;(3)Na2CO3+2HCl=2NaCl+H2O+CO2↑.
点评 本题难度不大,综合性较强.掌握常见金属锈蚀的原理和除锈原理是解决本题的关键.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
12.若将点燃的镁带插入盛满CO2的集气瓶中,镁带将继续燃烧,该反应的文字式可表示为“镁+二氧化碳$\stackrel{点燃}{→}$氧化镁+碳”.下列关于该反应的说法正确的是( )
| A. | CO2不能燃烧,也不能支持燃烧 | |
| B. | CO2不能支持燃烧 | |
| C. | 反应生成的固体属于混合物 | |
| D. | 该反应属于化合反应,不属于分解反应 |
16.下列叙述中,不符合实验事实的是( )
| A. | 在K2CO3、K2SO4、AgNO3三种溶液中分别滴入BaCl2溶液,都有白色沉淀生成 | |
| B. | 将SO3,加入到滴有石蕊试液的蒸馏水中,溶液显红色 | |
| C. | 未密封保存的苛性钠遇盐酸有气体生成 | |
| D. | 将稀硫酸溶液加入到某固体粉末中,有无色气体产生,该固体粉末一定是金属 |
6.为了测定某铜锌合金的组成,某校化学课外活动小组利用该合金粉末与稀硫酸反应,进行了三次实验,所得相关的实验数据记录如下:
(1)试计算该铜锌合金中锌的质量分数.
(2)从上表数据分析,当所取合金与所用稀硫酸的质量比为1:5时,表明合金中的锌与稀硫酸恰好完全反应.
(3)所用合金与稀硫酸恰好完全反应时所得溶液中溶质的质量分数.
| 第一次 | 第二次 | 第三次 | |
| 所取合金的质量/g | 10 | 10 | 20 |
| 所用稀硫酸的质量/g | 60 | 80 | 50 |
| 生成氢气的质量/g | 0.2 | 0.2 | 0.2 |
(2)从上表数据分析,当所取合金与所用稀硫酸的质量比为1:5时,表明合金中的锌与稀硫酸恰好完全反应.
(3)所用合金与稀硫酸恰好完全反应时所得溶液中溶质的质量分数.
13.硝酸钾溶液中混有少量的氢氧化钾,要除去氢氧化钾得到纯净的硝酸钾溶液,下列措施不正确的是( )
| A. | 加入适量硝酸铁溶液 | B. | 加入适量硝酸铜溶液 | ||
| C. | 加入适量硝酸溶液 | D. | 加入适量硫酸溶液 |
10.下列实验操作中,其中一项的操作目的与其他三项不属于同一类,该项操作是( )
| A. | 闭合电路开关前.将滑片移协到滑动变阻器的阻值最大处 | |
| B. | 做中和反应实验时,事先在碱溶液中滴入1~2滴酚酞试液 | |
| C. | 做氢气还原氧化铜实验时,先通一会儿氢气,把试管中的空气排尽 | |
| D. | 稀释浓硫酸时,要将浓硫酸沿容器壁缓慢注入水中,并用玻璃棒不断搅拌 |
11.氢气还原氧化铜实验得到的固体粉末为氧化铜和铜的混合物,科学兴趣小组的同学对该粉末中的单质铜的含量进行测定.三组同学各取5克粉末样品置于烧杯中,然后加入不同质量的同浓度的稀硫酸,充分反应后,对烧杯中剩余固体进行干燥称量.实验数据记录如表:
(1)分析表中数据可知,第1组实验中完全反应完的是A.
A.氧化铜 B.铜 C.稀硫酸
(2)样品中单质铜的质量分数为80%.
(3)加入的稀硫酸溶质质量分数是多少?(写出计算过程)
| 组别编号 | 样品质量(克) | 加入稀硫酸质量(克) | 剩余固体质量(克) |
| 1 | 5 | 10 | 4.2 |
| 2 | 5 | 15 | 4 |
| 3 | 5 | 20 | 4 |
A.氧化铜 B.铜 C.稀硫酸
(2)样品中单质铜的质量分数为80%.
(3)加入的稀硫酸溶质质量分数是多少?(写出计算过程)
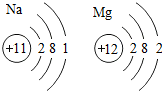 )推知,金属Na、Mg性质不同的原因是最外层电子数不同(合理即可);一氧化碳和二氧化碳性质不同的原因是分子构成不同(合理即可).由此可见,物质的结构决定物质的性质.
)推知,金属Na、Mg性质不同的原因是最外层电子数不同(合理即可);一氧化碳和二氧化碳性质不同的原因是分子构成不同(合理即可).由此可见,物质的结构决定物质的性质.