题目内容
2.某同学用碳酸钙和稀盐酸反应制取二氧化碳的实验后,得到一定量的溶液.为了确定该溶液的成分,该同学向反应后所得的溶液中逐渐加入一定质量分数的碳酸钠溶液,得到沉淀的质量与所加的碳酸钠溶液质量关系如表所示:| 加入Na2CO3溶液的质量/g | 25 | 50 | 75 | 100 | 125 |
| 生成沉淀的质量/g | 0 | 1 | 3 | 4 | X |
(1)对实验数据进行分析后该同学认为实验时他所取的盐酸过量,理由是加入25g碳酸钠溶液后没有产生沉淀;
(2)表格中X为4g.
(3)求所加碳酸钠溶液的溶质质量分数?
分析 碳酸钙和稀盐酸反应生成氯化钙、水和二氧化碳,碳酸钠和稀盐酸反应生成氯化钠、水和二氧化碳,碳酸钠和氯化钙反应生成白色沉淀碳酸钙和氯化钠;
根据表中数据可以判断反应情况、X的值,同时能够计算碳酸钠溶液的质量分数.
解答 解:(1)因为加入25g碳酸钠溶液后没有产生沉淀,说明碳酸钙和稀盐酸反应后,稀盐酸过量,过量的稀盐酸和碳酸钠反应,因此开始加入碳酸钠溶液后没有产生沉淀.
故填:加入25g碳酸钠溶液后没有产生沉淀.
(2)加入50g碳酸钠溶液时得到1g沉淀,加入75g碳酸钠溶液时得到3g沉淀,说明25g碳酸钠溶液和氯化钙反应生成2g沉淀,加入100g碳酸钠溶液时得到4g沉淀,说明此时氯化钙已经完全反应,继续加入碳酸钠溶液时,不再产生沉淀,因此X的值是4,
故填:4.
(3)设25g碳酸钠溶液中,碳酸钠的质量为x,
因为加入50g碳酸钠溶液时得到1g沉淀,加入75g碳酸钠溶液时得到3g沉淀,此时的碳酸钠溶液中的碳酸钠完全和氯化钙反应,
Na2CO3+CaCl2═CaCO3↓+2NaCl,
106 100
x 2g
$\frac{106}{x}$=$\frac{100}{2g}$,
x=2.12g,
所加碳酸钠溶液的溶质质量分数为:$\frac{2.12g}{25g}$×100%=8.48%,
答:所加碳酸钠溶液的溶质质量分数为8.48%.
点评 本题主要考查学生运用假设法和化学方程式进行计算和推断的能力,同时考查分析表中数据的能力,计算时要注意规范性和准确性.

练习册系列答案
相关题目
17.铁生绣的变化属于( )
| A. | 缓慢氧化 | B. | 置换反应 | C. | 物理变化 | D. | 以上都不对 |
7.下列气体,属于纯净物是( )
| A. | 洁净的空气 | B. | 汽车尾气 | C. | 水蒸气 | D. | 石灰石 |
14.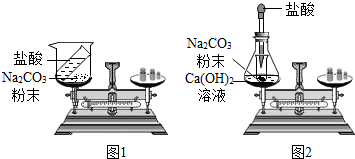 某班同学按如图所示的实验探究质量守恒定律.
某班同学按如图所示的实验探究质量守恒定律.
(1)同学们先按图1的方式实验,将盐酸加到碳酸钠粉末中发生反应的化学方程式为Na2CO3+2HCl=2NaCl+H2O+CO2↑.该实验中,大家进行了两次称量,有四个小组得到下列数据,其中有问题的两组数据是AD(填序号).
(2)同学们又按照图2的方式实验,当天平平衡后,挤压胶头滴管逐滴滴人盐酸,最终天平的状态是C(填序号).
A.左盘高 B.右盘高 C.保持平衡
该实验中通过化学反应新生成了的物质有BC(填序号).
A.HC1 B.CO2 C.CaCO3 D.Ca(OH )2.
 某班同学按如图所示的实验探究质量守恒定律.
某班同学按如图所示的实验探究质量守恒定律.(1)同学们先按图1的方式实验,将盐酸加到碳酸钠粉末中发生反应的化学方程式为Na2CO3+2HCl=2NaCl+H2O+CO2↑.该实验中,大家进行了两次称量,有四个小组得到下列数据,其中有问题的两组数据是AD(填序号).
| A | B | C | D | |
| 盐酸加入Na2 CO3粉末前称量/g | 85.3 | 82.8 | 84.8 | 86.5 |
| 盐酸加入Na2 CO3粉末后称量/g | 85.3 | 80.6 | 83.2 | 87.8 |
A.左盘高 B.右盘高 C.保持平衡
该实验中通过化学反应新生成了的物质有BC(填序号).
A.HC1 B.CO2 C.CaCO3 D.Ca(OH )2.
11.只用一种试剂就能一步鉴别MgCl2、BaCl2和Ca(OH)2三种溶液,这种试剂是( )
| A. | 酚酞溶液 | B. | 硝酸银溶液 | C. | 碳酸钠溶液 | D. | 硫酸铜溶液 |
12.漂白粉的主要成分为次氯酸钙[Ca(ClO)2]和氯化钙,既可用作漂白剂,又可用作消毒剂.漂白粉中有效成分是[Ca(ClO)2],漂白的原理是:Ca(ClO)2在空气中发生反应Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO;HClO是一种酸性比盐酸弱的酸,不稳定,具有漂白性,能使品红等有色物质褪色.
(1)漂白粉是一种混合物(填“纯净物”或“混合物”).
(2)HClO在常温下分解,反应为2HClO=2HCl+O2↑.某瓶HClO溶液放置一段时间后,溶液的pH减小(填“增大”或“减小”或“不变”).
(3)有一包长时间放置的漂白粉,想知道该漂白粉是否变质,某同学设计了下列探究实验.
【提出问题】长时间放置的漂白粉是否变质?
【猜想】
猜想1:该漂白粉未变质,固体成分为CaCl2、Ca(ClO)2;
猜想2:该漂白粉部分变质,固体成分为CaCl2、Ca(ClO)2、CaCO3;
猜想3:该漂白粉全部变质,固体成分为CaCl2、CaCO3.
【实验探究】限选试剂及仪器:盐酸、石灰水、品红溶液、试管、带导管的单孔塞.
(1)漂白粉是一种混合物(填“纯净物”或“混合物”).
(2)HClO在常温下分解,反应为2HClO=2HCl+O2↑.某瓶HClO溶液放置一段时间后,溶液的pH减小(填“增大”或“减小”或“不变”).
(3)有一包长时间放置的漂白粉,想知道该漂白粉是否变质,某同学设计了下列探究实验.
【提出问题】长时间放置的漂白粉是否变质?
【猜想】
猜想1:该漂白粉未变质,固体成分为CaCl2、Ca(ClO)2;
猜想2:该漂白粉部分变质,固体成分为CaCl2、Ca(ClO)2、CaCO3;
猜想3:该漂白粉全部变质,固体成分为CaCl2、CaCO3.
【实验探究】限选试剂及仪器:盐酸、石灰水、品红溶液、试管、带导管的单孔塞.
| 实验操作 | 实验现象 | 实验结论 |
| ①取少量样品于试管中,加入适量的稀盐酸,塞上带导管的单孔塞,把导管插入另一试管里的石灰水中. | 有气体产生,气体使石灰水变浑浊. | 猜想2成立 |
| ②在上述反应后的试管中加少量品红溶液. | 品红溶液褪色 |