题目内容
3.(1)已知3X+2Y=2Z+W,X、Y两物质完全反应时的质量比为3:4,若生成Z和W共140g,则该反应消耗Y的质量为80g.(2)在化学反应2X+Y2=2Z,X的相对原子质量为24,Y的相对原子质量为32,则Z的相对原子质量为56.
(3)在反应2X+5Y=2Z+4W中,Z与W的相对分子质量之比为9:12,若2.6gX与Y完全反应,生成8.8gW,则在此反应中Y与W的质量比为10:11.
分析 (1)根据质量守恒定律可知参加化学反应的各物质质量总和等于反应后生成的各物质质量总和,即参加反应的A和B的质量和跟生成C和D的质量和相等;
(2)根据质量守恒定律,反应物的总质量等于生成物的总质量;
(3)根据Z与W的相对质量之比及反应中Z与W物质的分子个数关系,计算出参加反应中两物质的质量关系;根据Z与W物质的质量关系,由生成W的质量计算出生成Z物质的质量;最后使用质量守恒定律,求得参加反应的Y物质的质量,即可计算出Y与W的质量比.
解答 解:(1)由质量守恒定律,生成C和D共140g,则参加反应的A和B的质量之和也为140g,而A、B两物质完全反应时的质量比为3:4,故反应消耗B的质量是140g×$\frac{4}{3+4}$=80g;故填:80g;
(2)根据质量守恒定律,2×24+32×2=2×Z的相对分子质量,则Z的相对分子质量为56.故填:56;
(3)根据“Z与W相对分子质量之比为9:22”,则假设Z与W相对分子质量分别为9、22,
设生成8.8gW同时生成Z的质量为x,
2X+5Y=2Z+4W
2×9 4×22
x 8.8g
$\frac{18}{88}=\frac{x}{8.8g}$
x=1.8g
根据质量守恒定律参加反应的Y的质量为1.8g+8.8g-2.6g=8g,则Y与W的质量比为8g:8.8g=10:11.故填:10:11
点评 本道题主要考查了有关质量守恒定律的应用,解本题的关键是反应物的相对分子质量总和与生成物的相对分子质量总和相等.

练习册系列答案
相关题目
18.凡是有元素化合价发生改变的化学反应都是氧化还原反应.下列反应属于氧化还原反应的是( )
| A. | CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑ | B. | HCl+NaOH═NaCl+H2O | ||
| C. | CO+CuO$\frac{\underline{\;\;△\;\;}}{\;}$Cu+CO2 | D. | Fe+CuSO4=Cu+FeSO4 |
8.元素M的氧化物化学式是MO,在此氧化物的水溶液中滴入无色酚酞试液后变红,则元素M是( )
| A. | 铜 | B. | 钠 | C. | 硫 | D. | 钙 |


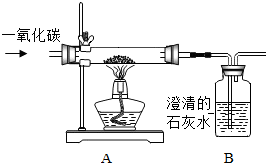 某同学使用如图所示装置,试验一氧化碳与磁铁矿的反应.请回答下列有关问题:
某同学使用如图所示装置,试验一氧化碳与磁铁矿的反应.请回答下列有关问题: