题目内容
7.现代循环经济要求综合考虑环境污染和经济效益.高纯氧化铁可作现代电子工业的材料,以下是用硫铁矿烧渣(主要成分为Fe2O3、FeO、SiO2)为原料制备高纯氧化铁(Fe2O3)的生产流程示意图:[(NH4)2CO3溶液呈碱性,40℃以上时(NH4)2CO3分解].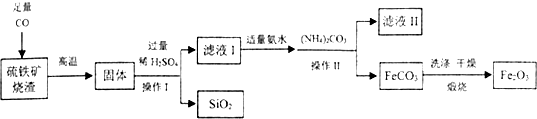
(1)写出足量CO与硫铁矿烧渣的主要成分反应方程式Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2,或FeO+CO$\frac{\underline{\;高温\;}}{\;}$Fe+CO2.(任写一个)
(2)滤液Ⅰ中主要的阳离子是亚铁离子、氢离子等.
(3)加适量氨水的目的是中和过量的硫酸.
(4)根据题中信息,加入(NH4)2CO3后,该反应必须控制的条件是温度在40℃以下.
(5)滤液Ⅱ中可回收的产品在生活中可作为氮肥.
(6)写出在空气中煅烧FeCO3的化学反应方程式FeCO3$\frac{\underline{\;高温\;}}{\;}$FeO+CO2↑.
分析 (1)高温条件下,氧化铁和一氧化碳反应生成铁和二氧化碳,氧化亚铁和一氧化碳反应生成铁和二氧化碳;
(2)滤液Ⅰ中主要的阳离子是亚铁离子和氢离子等.
(3)氨水属于碱,能和硫酸发生中和反应;
(4)加入(NH4)2CO3后,为了防止碳酸铵分解,温度应该控制在40℃以下;
(5)含有氮元素的化肥属于氮肥;
(6)在空气中煅烧碳酸亚铁时,碳酸亚铁分解生成氧化亚铁和二氧化碳.
解答 解:(1)高温条件下,氧化铁和一氧化碳反应生成铁和二氧化碳,氧化亚铁和一氧化碳反应生成铁和二氧化碳,反应的化学方程式为:Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2,FeO+CO$\frac{\underline{\;高温\;}}{\;}$Fe+CO2.
故填:Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2,或 FeO+CO$\frac{\underline{\;高温\;}}{\;}$Fe+CO2.
(2)滤液Ⅰ中主要的阳离子有反应生成的硫酸亚铁中的亚铁离子和过量的硫酸中的氢离子.
故填:亚铁离子、氢离子.
(3)加适量氨水的目的是中和过量的硫酸.
故填:中和过量的硫酸.
(4)因为40℃以上时(NH4)2CO3分解,因此加入(NH4)2CO3后,温度控制在40℃以下.
故填:温度在40℃以下.
(5)滤液Ⅱ中可回收的产品中含有硫酸铵,在生活中可作为氮肥.
故填:氮.
(6)在空气中煅烧碳酸亚铁时,碳酸亚铁分解生成氧化亚铁和二氧化碳,反应的化学方程式为:FeCO3$\frac{\underline{\;高温\;}}{\;}$FeO+CO2↑.
故填:FeCO3$\frac{\underline{\;高温\;}}{\;}$FeO+CO2↑.
点评 本题主要考查物质的性质,解答时要根据各种物质的性质,结合各方面条件进行分析、判断,从而得出正确的结论.

 状元坊全程突破导练测系列答案
状元坊全程突破导练测系列答案| A. | 15mL | B. | 15.1mL | C. | 15.12mL | D. | 15.125mL |
 学校化学兴趣小组欲测定某含杂质的锌粒中锌的质量分数,小亮同学称取10g该样品加入到足量的稀硫酸中(杂质不溶于水也不与酸反应),测得一定时间内生成气体的质量如表所示:
学校化学兴趣小组欲测定某含杂质的锌粒中锌的质量分数,小亮同学称取10g该样品加入到足量的稀硫酸中(杂质不溶于水也不与酸反应),测得一定时间内生成气体的质量如表所示:| 时间(min) | 1 | 2 | 3 | 4 | 5 |
| H2的质量(g) | 0.08 | 0.16 | 0.2 | 0.2 | m |
(1)m的值为0.2;
(2)此锌粒中锌的质量分数为65%;
(3)上述实验过程中,生成H2的质量与消耗硫酸的质量的关系如图所示,试求稀硫酸的溶质质量分数(写出计算过程);
(4)当恰好完全反应时,生成的溶液的质量为56.3g.
| 序号 | 金属 | 熔点/℃ | 导电性 | 硬度 | 化学性质 | 金属冶炼的大致年限 |
| ① | Al | 660 | 61 | 2~2.9 | 常温下与氧气反应,表面形成致密的薄膜 | 约200年前 |
| ② | Fe | 1535 | 17 | 4~5 | 在潮湿的空气着火易生锈 | 约3000年前 |
| ③ | Cu | 1083 | 99 | 2.5~3 | 在高温时易与氧气反应 | 约6000年前 |
(1)菜刀用铁做而不用铝做的主要原因铁的硬度比铝大;
(2)表中导电性最强的金属是Cu;
(3)金属的冶炼体现了人类文明的发展水平.之所以有先后,取决于金属的活动性;
(4)①中形成薄膜的化学方程式4Al+3O2=2Al2O3.
| A. | 开发太阳能 | B. | 禁止使用煤 | C. | 禁止使用汽油 | D. | 禁止使用天然气 |
| A. | Na2CO3,K2CO3,CuCl2 | B. | FeCl3,NaCl,Ca(NO3)2 | ||
| C. | NaOH,KNO3,CaCl2 | D. | Ca(NO3)2,FeCl2,Na2CO3 |
 如图表示海水盐分中各成分的质量分数.请据图回答下列问题:
如图表示海水盐分中各成分的质量分数.请据图回答下列问题: (1)指出图中所标的仪器的名称
(1)指出图中所标的仪器的名称