题目内容
12. 甲同学对有关盐的知识进行了以下的整理.
甲同学对有关盐的知识进行了以下的整理.| 硫酸钾 | 硫酸钙 | 硫酸钠 | 硫酸镁 | 硫酸铝 | 硫酸锌 | 硫酸亚铁 |
| K2SO4 | CaSO4 | Na2SO4 | MgSO4 | Al2(SO4)3 | ZnSO4 | FeSO4 |
(2)上述盐因组成上相似而具有某些共同的化学性质,如都能与BaCl2溶液反应而生成沉淀.
(3)甲同学通过查阅资料,发现许多反应都有盐类物质生成.他将这些知识间相互关系整理成如图,请将如图补充完整
a酸.
(4)乙同学提出可用右图指导进行物质的制备:请写出1个有硫酸铁生成的化学反应方程式.
答:Fe+H2SO4═FeSO4+H2↑.
分析 根据物质的性质进行分析,根据盐的名称可以看出盐的排列顺序与盐中所含有的金属的活动性顺序有关,根据复分解反应的条件即可写出盐与氯化钡反应的化学方程式,酸和碱都能反应生成盐,铁能与酸反应生成亚铁盐,铁的氧化物氧化亚铁能与酸反应生成亚铁盐.
解答 解:(1)根据盐中所含有的金属,可以看出这些盐是按照其中所含有的金属的活动性顺序排列的,所以本题答案为:金属活动性;
(2)硫酸钾能与氯化钡反应生成硫酸钡沉淀和氯化钾,所以本题答案为:BaCl2溶液;
(3)酸和碱都能与某些物质反应生成盐,所以本题答案为:酸;
(4)根据图示可以看出,要生成硫酸亚铁,可以使用金属铁或铁的氧化物与稀硫酸的反应,铁能与稀硫酸反应生成硫酸亚铁和氢气,氧化亚铁能与硫酸反应生成硫酸亚铁和水,所以本题答案为:Fe+H2SO4═FeSO4+H2↑,
点评 本题考查了常见盐的化学性质以及有关反应化学方程式的书写,完成此题,可以依据已有的知识进行,要求同学们加强对物质间反应的识记,以便灵活应用.

练习册系列答案
相关题目
2.化学在能源、材料和环境等研究领域发挥着重要作用.下列说法不正确的是( )
| A. | 二氧化碳、甲烷和淀粉都属于有机物 | |
| B. | 石油、煤和天然气都是不可再生能源 | |
| C. | 合金是一种混合物,它可以看成是一种溶液 | |
| D. | 太阳能、风能和地热能的利用都有利于保护环境 |
20.洁净的铁钉在下列情况中,锈蚀最快的是( )
| A. |  | B. |  | C. |  | D. |  |
7.除去下列物质中的杂质(括号内为杂质),所选用试剂及操作方法均正确的是( )
| 选项 | 待提纯的物质 | 选用的试剂 | 操作方法 |
| A | NaCl(Na2CO3) | CaCl2溶液 | 加适量CaCl2溶液,过滤、将滤液蒸发结晶 |
| B | Na2SO4(NaOH) | 稀盐酸 | 加过量稀盐酸、蒸发结晶 |
| C | KCl(KClO3) | MnO2 | 加MnO2,加热后冷却 |
| D | Fe2(SO4)3溶液(CuSO4) | 过量铁粉 | 过滤 |
| A. | A | B. | B | C. | C | D. | D |
17.分离、提纯是化学实验的重要环节,下列设计不能达到实验目的是( )
| 选项 | 物质 | 杂质 | 试剂或方法 |
| A | NaCl 固体 | 泥沙 | 加水溶解、过滤、蒸发 |
| B | KCl 溶液 | K2SO4 | 滴加足量Ba(NO3)2溶液并过滤 |
| C | KNO3溶液 | Ba(NO3)2 | 滴加适量K2SO4溶液、过滤 |
| D | N2 | O2 | 通过红热的铜丝 |
| A. | A | B. | B | C. | C | D. | D |
4.工业上利用乙炔(C2H2)产生的灰浆和残渣制备化工原料KClO3和超细CaCO3.
生产流程为:电石(CaC2)$\stackrel{水}{→}$灰浆$\stackrel{置露于空气}{→}$残渣.
资料:电石与水的反应为:CaC2+2H2O=Ca(OH)2+C2H2↑.
(1)残渣中主要成分是Ca(OH)2和CaCO3.
Ⅰ.制备KClO3的流程如下:
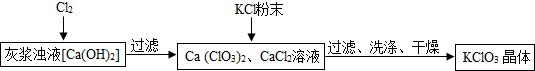
(2)向灰浆浊液中通入Cl2,得到Ca(ClO3)2、CaCl2溶液.反应中Ca(ClO3)2与CaCl2的化学计量数分别为1和5.写出此反应的化学方程式6Ca(OH)2+6Cl2=Ca(ClO3)2+5CaCl2+6H2O.
(3)有关物质在常温下的溶解度如下:
上述流程中加入KCl粉末,KCl与Ca(ClO3)2(填化学式)发生了复分解反应,得到KClO3晶体.你认为能得到KClO3晶体的原因是相同温度下,氯酸钾的溶解度小.
(4)洗涤时,可选用下列BC洗涤剂(填字母编号).
A、KCl饱和溶液 B、冰水 C、饱和KClO3溶液
Ⅱ.制备超细CaCO3的流程如下(注:加入NH4Cl的目的是溶解残渣中的难溶盐):
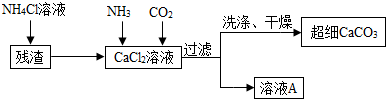
(5)流程中溶液A可循环使用,其主要成分的化学式是NH4Cl.
生产流程为:电石(CaC2)$\stackrel{水}{→}$灰浆$\stackrel{置露于空气}{→}$残渣.
资料:电石与水的反应为:CaC2+2H2O=Ca(OH)2+C2H2↑.
(1)残渣中主要成分是Ca(OH)2和CaCO3.
Ⅰ.制备KClO3的流程如下:

(2)向灰浆浊液中通入Cl2,得到Ca(ClO3)2、CaCl2溶液.反应中Ca(ClO3)2与CaCl2的化学计量数分别为1和5.写出此反应的化学方程式6Ca(OH)2+6Cl2=Ca(ClO3)2+5CaCl2+6H2O.
(3)有关物质在常温下的溶解度如下:
| 物质 | Ca(ClO3)2 | CaClO3 | KClO3 | KCl |
| 溶解度/g | 209.0 | 74.5 | 7.3 | 34.2 |
(4)洗涤时,可选用下列BC洗涤剂(填字母编号).
A、KCl饱和溶液 B、冰水 C、饱和KClO3溶液
Ⅱ.制备超细CaCO3的流程如下(注:加入NH4Cl的目的是溶解残渣中的难溶盐):

(5)流程中溶液A可循环使用,其主要成分的化学式是NH4Cl.
1. 如图所示装置可用于测定空气中氧气的含量,实验前在集气瓶内加入少量水,并做上记号.下列有关该实验的说法中不正确的是( )
如图所示装置可用于测定空气中氧气的含量,实验前在集气瓶内加入少量水,并做上记号.下列有关该实验的说法中不正确的是( )
 如图所示装置可用于测定空气中氧气的含量,实验前在集气瓶内加入少量水,并做上记号.下列有关该实验的说法中不正确的是( )
如图所示装置可用于测定空气中氧气的含量,实验前在集气瓶内加入少量水,并做上记号.下列有关该实验的说法中不正确的是( )| A. | 红磷熄灭后应立刻打开弹簧夹 | |
| B. | 点燃红磷前先用弹簧夹夹紧橡皮管 | |
| C. | 最终瓶中剩余的气体主要是氮气 | |
| D. | 实验时,只取用极少量红磷,可减少污染且不影响实验结果 |
 A~E均为初中化学常见物质,A、B、C、D、E均含有同一种元素,B常用于改良酸性土壤.它们之间的相互转化关系如图所示:(图中“→”表示物质间存在转化关系,部分生成物已略去).请回答下列问题:
A~E均为初中化学常见物质,A、B、C、D、E均含有同一种元素,B常用于改良酸性土壤.它们之间的相互转化关系如图所示:(图中“→”表示物质间存在转化关系,部分生成物已略去).请回答下列问题: