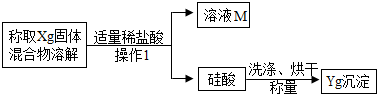
题目内容
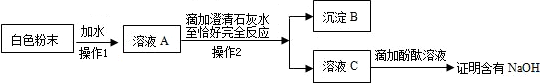
28、证明一白色粉末是硫酸铜,在以下四种方法①取少量溶于水,加NaOH溶液,有蓝色沉淀生成②取少量溶于水,加稀H2SO4不反应③取少量溶于水,加Ba(NO3)2溶液和稀HNO3,有白色沉淀生成.可以选用的是( )
分析:根据铜离子会与氢氧根离子生成蓝色沉淀,硫酸根离子会与钡离子生成不溶于硝酸的白色沉淀进行分析.
解答:解:①所有的钠盐都溶于水,在加入氢氧化钠后生成蓝色的沉淀,根据复分解反应的原理可知,铜离子来自未知的溶液中;所有的硝酸银都溶于水,不溶于硝酸的沉淀有氯化银和硫酸钡,在加入硝酸钡和稀硝酸后生成了白色沉淀,根据复分解反应的原理可知,硫酸根离子来自未知的溶液中,所以该物质就是硫酸铜,
故选D.
故选D.
点评:在解此类题时,首先分析需要鉴别物质的离子,然后分别选择试剂鉴别离子就可以了.

练习册系列答案
 学业测评一课一测系列答案
学业测评一课一测系列答案 小学课时作业全通练案系列答案
小学课时作业全通练案系列答案
相关题目
 (2013?安顺)潜水员使用的供氧装置是用过氧化钠(Na2O2)和呼出的CO2反应来制取氧气提供呼吸.某实验小组为验证这一原理,进行了实验探究.
(2013?安顺)潜水员使用的供氧装置是用过氧化钠(Na2O2)和呼出的CO2反应来制取氧气提供呼吸.某实验小组为验证这一原理,进行了实验探究.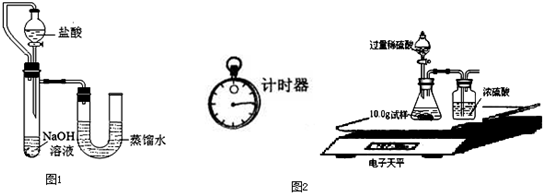
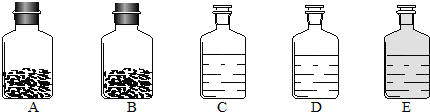
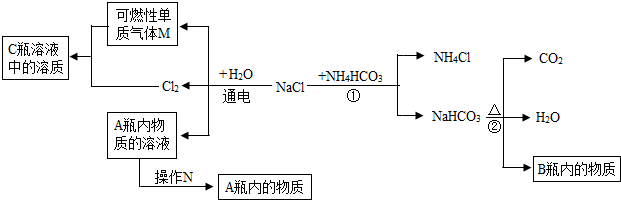
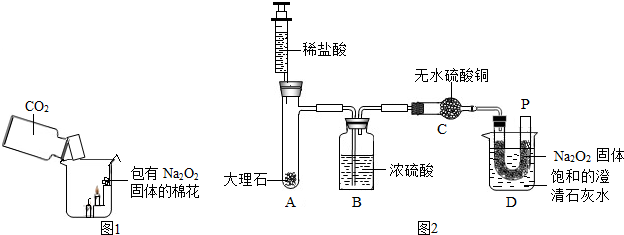
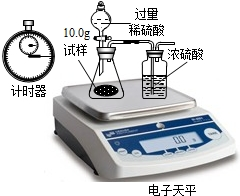
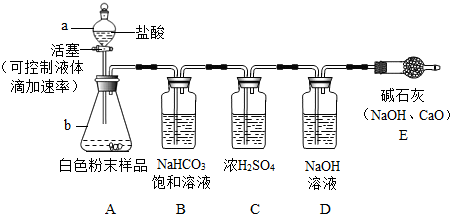
 有一混合气体,可能是H2、CO、CO2中的一种或几种,现将混合气体通过下图所示的装置确定其组成:(其中浓硫酸起到吸收水分的作用,U形管中的白色无水硫酸铜粉末变为蓝色,证明有水生成)
有一混合气体,可能是H2、CO、CO2中的一种或几种,现将混合气体通过下图所示的装置确定其组成:(其中浓硫酸起到吸收水分的作用,U形管中的白色无水硫酸铜粉末变为蓝色,证明有水生成)