题目内容
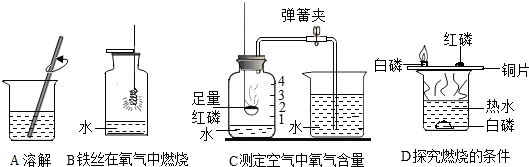
7. 化学兴趣小组同学对测定氧气含量的实验装置进行了改造,如图所示,请回答下列问题:
化学兴趣小组同学对测定氧气含量的实验装置进行了改造,如图所示,请回答下列问题:(1)凸透镜对光有会聚作用.
(2)写出红磷在空气中燃烧的化学方程式4P+5O2$\frac{\underline{\;点燃\;}}{\;}$2P2O5.
(3)该实验不能选用木炭、硫粉代替红磷的原因是虽除去氧气,但增加了新的气体,不能用于代替红磷.
分析 (1)根据凸透镜对光有会聚作用,进行分析解答.
(2)红磷在空气中燃烧生成五氧化二磷,写出反应的化学方程式即可.
(3)所选除氧剂要具备以下特征:本身能够在空气中燃烧;本身的状态为非气体;生成的物质为非气态;据此进行分析解答.
解答 解:(1)凸透镜对光有会聚作用.
(2)红磷在空气中燃烧生成五氧化二磷,反应的化学方程式为:4P+5O2$\frac{\underline{\;点燃\;}}{\;}$2P2O5.
(3)木炭在空气中燃烧生成二氧化碳气体或者一氧化碳气体甚至是两者的混合气体,虽除去氧气,而增加了新的气体;硫粉在空气中能够燃烧生成二氧化硫气体,虽除去氧气,但增加了新的气体;均不能用来测定空气中氧气含量.
故答案为:(1)会聚;(2)4P+5O2$\frac{\underline{\;点燃\;}}{\;}$2P2O5;(3)虽除去氧气,但增加了新的气体,不能用于代替红磷.
点评 本题难度不大,掌握用燃烧法测定空气中氧气含量的实验原理、注意事项等是正确解答本题的关键.

练习册系列答案
 宝贝计划期末冲刺夺100分系列答案
宝贝计划期末冲刺夺100分系列答案 能考试全能100分系列答案
能考试全能100分系列答案
相关题目
15.小馨同学在复习化学知识时,有如下归纳或总结,你认为不正确的是( )
| A. | 碱都含有氢元素,但含有氢元素的化合物不一定是碱 | |
| B. | 糖类、蛋白质、油脂、纤维素、盐和水,通常称为营养素 | |
| C. | 用加水溶解的方法检验纯碱中是否混入了食盐 | |
| D. | 中和反应有盐和水生成,有盐和水生成的反应不一定是中和反应 |
12.某化学兴趣小组在实验室中模拟工业炼铁的原理,并探究CO与Fe2O3反应的生成物,通过查阅资料知道::①草酸(H2C2O4)固体与浓硫酸混合加热会产生一氧化碳,反应方程式为:H2C2O4$\frac{\underline{\;浓硫酸\;}}{△}$CO↑+CO2↑+H2O.
②NaOH溶液可以吸收二氧化碳,
③常温下,Ca(OH)2微溶于水;于是他设计了如图1的实验装置,结合装置回答下列问题:

(1)图A是用固体草酸和浓硫酸制取CO的反应装置,你认为应选择图2中的丁(填装置编号);
(2)图中装置C、D的作用分别是判断二氧化碳是否被氢氧化钠溶液完全吸收、干燥一氧化碳气体;
(3)该装置设计有一个明显缺陷,你认为是没有处理尾气.
(4)实验时准确称取一定质量纯净的Fe2O3固体按图进行实验,当E中固体全部变黑后,继续通入CO直到玻璃管冷却.将得到黑色的固体加入到足量的稀盐酸,发现固体全部溶解,但无气泡产生.
查阅资料:a.铁的氧化物在足量的稀盐酸中均能全部溶解.
b.Fe2O3与CO反应的固体生成物可能情况如下:Fe2O3$\stackrel{400℃~500℃}{→}$Fe3O4$\stackrel{500℃~600℃}{→}$$\underset{FeO}{黑色}$$\stackrel{700℃~800℃}{→}$Fe
根据“无气泡”猜想,黑色粉末可能是:①Fe3O4;②FeO;③Fe3O4、FeO
(5)定量分析,用电子天平称量得部分数据如下:
根据上述数据,推断出反应后黑色固体的成分是Fe3O4.
②NaOH溶液可以吸收二氧化碳,
③常温下,Ca(OH)2微溶于水;于是他设计了如图1的实验装置,结合装置回答下列问题:

(1)图A是用固体草酸和浓硫酸制取CO的反应装置,你认为应选择图2中的丁(填装置编号);
(2)图中装置C、D的作用分别是判断二氧化碳是否被氢氧化钠溶液完全吸收、干燥一氧化碳气体;
(3)该装置设计有一个明显缺陷,你认为是没有处理尾气.
(4)实验时准确称取一定质量纯净的Fe2O3固体按图进行实验,当E中固体全部变黑后,继续通入CO直到玻璃管冷却.将得到黑色的固体加入到足量的稀盐酸,发现固体全部溶解,但无气泡产生.
查阅资料:a.铁的氧化物在足量的稀盐酸中均能全部溶解.
b.Fe2O3与CO反应的固体生成物可能情况如下:Fe2O3$\stackrel{400℃~500℃}{→}$Fe3O4$\stackrel{500℃~600℃}{→}$$\underset{FeO}{黑色}$$\stackrel{700℃~800℃}{→}$Fe
根据“无气泡”猜想,黑色粉末可能是:①Fe3O4;②FeO;③Fe3O4、FeO
(5)定量分析,用电子天平称量得部分数据如下:
| 玻璃管质量 | 玻璃管及其中固体的质量 | 装置F及其中物质的总质量 | |
| 反应前 | 28.20g | 33.00g | 300.0g |
| 反应后 | 32.84g | 300.4g |