题目内容
8. 为了测定黄铜(铜、锌合金)的组成,某研究性学习小组称取该样品10g,向其中逐滴加入9.8%的稀硫酸至刚好不再产生气体为止.反应过程中生成的气体与所用硫酸溶液的质量关系如图所示.试计算:
为了测定黄铜(铜、锌合金)的组成,某研究性学习小组称取该样品10g,向其中逐滴加入9.8%的稀硫酸至刚好不再产生气体为止.反应过程中生成的气体与所用硫酸溶液的质量关系如图所示.试计算:(1)反应所消耗的硫酸溶液质量;
(2)反应后所得溶液的溶质的质量分数.
分析 由图示可知生成氢气的质量为0.1g,根据氢气算出锌和硫酸、生成硫酸锌的质量,再计算质量分数.
解答 解:设要生成0.1g氢气需要锌的质量为x,硫酸的质量为y,生成硫酸锌的质量为z
则:
Zn+H2SO4═ZnSO4+H2↑
65 98 161 2
x y z 0.1g
$\frac{65}{x}=\frac{98}{y}=\frac{161}{z}=\frac{2}{0.1g}$
x=3.25g y=4.9g z=8.05g
(1)反应所消耗的硫酸溶液质量为:4.9g÷9.8%=50g;
(2)反应后所得溶液的溶质的质量分数为:$\frac{8.05g}{3.25g+50g-0.1g}×100%$≈15.1%
答:(1)反应所消耗的硫酸溶液质量为50g;
(2)反应后所得溶液的溶质的质量分数为15.1%.
点评 解答本题的关键是根据图示知道生成氢气质量为0.1g,再根据氢气质量算出各物质的质量.

练习册系列答案
相关题目
10.下列实验操作不正确的是( )
| A. |  | B. |  | C. |  | D. |  |
19.关于物质的转化过程:H2→H2O,CO→CO2,Fe→Fe3O4.下列说法不正确的是( )
| A. | 都能通过化合反应实现 | B. | 都能通过置换反应实现 | ||
| C. | 都能通过与单质反应实现 | D. | 变化前后都有元素化合价发生改变 |
3.下列物质的用途主要是由其化学性质决定的是( )
| A. | 用铝作导热材料 | B. | 用铜抽成丝做电线 | ||
| C. | 用氮气作食品防腐剂 | D. | 稀有气体充入霓虹灯 |
13.下列变化中属于化学变化的是( )
| A. | 纸张燃烧 | B. | 蜡烛熔化 | C. | 雕刻印章 | D. | 干冰升华 |
20.分类、类比是初中化学常用的学习方法.
(1)初中化学有许多实验,为了便于研究我们可以把化学实验从“实验装置、物质的性质、探究的方法”等角度进行分类,据此应将下列实验中的D与C(填“A”或“B”或“C”)归为一类,依据是都是探究物质的性质.
(2)过氧化钠可用在呼吸面具中作为氧气的来源,其反应原理为2Na2O2+2CO2═2Na2CO3+O2,Na2O2中的氧元素化合价为-1价,而Na2CO3中的氧元素为-2价,O2中氧元素的化合价为0价,因此过氧化钠中的氧元素化合价既有升高的,也有降低的,这样的反应叫做歧化反应.以下两个反应中属于歧化反应的是②(填序号),氯元素化合价既有升高的也有降低的.
①Ca(ClO)2+2HCl═CaCl2+2HClO ②Cl2+H2O═HCl+HClO.
(1)初中化学有许多实验,为了便于研究我们可以把化学实验从“实验装置、物质的性质、探究的方法”等角度进行分类,据此应将下列实验中的D与C(填“A”或“B”或“C”)归为一类,依据是都是探究物质的性质.
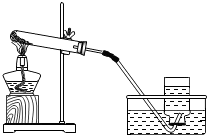 | 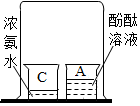 | 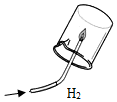 | 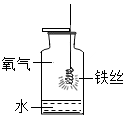 |
| A | B | C | D |
①Ca(ClO)2+2HCl═CaCl2+2HClO ②Cl2+H2O═HCl+HClO.
18.下列实验操作正确合理的是( )
| A. |  量取9.5ml液体 | B. |  测定溶液的pH | ||
| C. |  闻气体气味 | D. |  点燃酒精灯 |
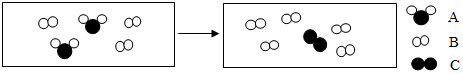
 ”的相对原子质量是“
”的相对原子质量是“ ”的n 倍,则A,B,C三种物质的质量比是(2+n):4:2n.
”的n 倍,则A,B,C三种物质的质量比是(2+n):4:2n.