题目内容
5.现有某黄铜(铜锌合金,假定其他成分均不与盐酸反应)样品,请从图中选择适当的实验装置,设计最简单的实验测定该黄铜样品中锌的质量分数并回答下列问题: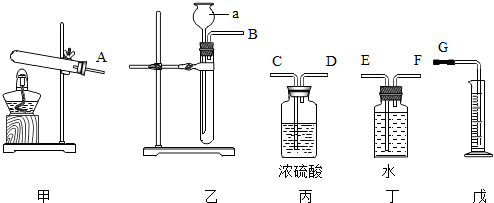
(1)写出仪器a的名称:长颈漏斗.
(2)实验要选择的装置是乙、丁、戊(填装置编号).若产生的气体从左向右流,则接口的顺序为B→F→E→G;
(3)细心观察发现:盛装溶液的试剂瓶与收集气体的集气瓶都有磨砂部分,所不同的是集气瓶的磨砂部分位于b.
a.瓶底内壁b.瓶口边缘c.瓶颈内壁d.瓶底外壁
(4)仪器组装好后,在开始实验时,要先检查装置的气密性.
(5)若实验样品的质量是9.9g,实验中测定氢气的体积是1.1L(氢气密度为0.09g/L),该反应的化学方程式Zn+2HCl═ZnCl2+H2↑,则该黄铜样品中锌的质量分数为32.5%.
分析 (1)根据常见仪器的名称和用途进行解答;
(2)根据锌和盐酸反应属于固体和液体混合不需要加热的反应进行解答;
(3)根据集气瓶的特征进行解答;
(4)根据仪器组装好后,在开始实验时,要先检查装置的气密性进行解答;
(5)根据氢气的体积求出氢气的质量,进而求出金属锌的质量,从而求出该黄铜样品中锌的质量分数即可.
解答 解:(1)仪器a的名称:长颈漏斗;
故答案为:长颈漏斗;
(2)锌和盐酸反应属于固体和液体混合不需要加热的反应,此实验要测出氢气的体积,所以实验要选择的装置是乙、丁、戊,接口的顺序为B→F→E→G;
故答案为:乙、丁、戊;B→F→E→G;
(3)盛装溶液的试剂瓶与收集气体的集气瓶都有磨砂部分,所不同的是集气瓶的磨砂部分位于瓶口边缘;
故答案为:b;
(4)仪器组装好后,在开始实验时,要先检查装置的气密性;
故答案为:检查装置的气密性;
(5)氢气的质量=1.1L×0.09g/L=0.099g.
设金属锌的质量为x.
Zn+2HCl═ZnCl2+H2↑
65 2
x 0.099g
$\frac{65}{x}=\frac{2}{0.099g}$
x=3.2175g
该黄铜样品中锌的质量分数=$\frac{3.215g}{9.9g}$×100%=32.5%.
答案:
(1)长颈漏斗;
(2)乙、丁、戊;B→F→E→G;
(3)b;
(4)检查装置的气密性;
(5)Zn+2HCl═ZnCl2+H2↑;32.5%.
点评 根据所给的实验数据分析求出氢气的体积,并明确参加反应的是固体中的锌,这是解决本题的关键.

练习册系列答案
相关题目
15.胃液里含有适量的盐酸可以帮助消化,但若盐酸过多,人就会感到不舒服.有下列几种物质:(1)NaOH (2)Ca(OH)2(3)Al(OH)3(4)Na2CO3,你认为可服用作治疗胃酸过多的药物有( )
| A. | NaOH | B. | Ca(OH)2 | C. | Al(OH)3 | D. | NaHCO3 |
16.下列有关化学主题知识的归纳,完全正确的一组是( )
| A.安全常识 | B.物质用途 |
| 加油站严禁烟火 熄灭酒精灯用嘴吹灭酒精灯 | 液态氧气火箭的燃料 二氧化碳常见的灭火剂 |
| C.环境影响 | D.元素与健康 |
| 酸雨含硫、氮等矿物燃料的燃烧 温室效应二氧化碳含量过高 | 缺钙会导致甲状腺疾病 缺铁会导致贫血 |
| A. | A | B. | B | C. | C | D. | D |
20.物质的性质决定用途,下列说法不正确的是( )
| A. | 氢氧化钠可以作食品干燥剂 | B. | 干冰可以用于人工降雨 | ||
| C. | 稀硫酸可以除铁锈 | D. | 氯化钠可以配制生理盐水 |
10.下列物质中,不能跟NaOH 溶液发生反应的是( )
| A. | CuO | B. | SO2 | C. | H2SO4 | D. | CuCl2 |
 食品保鲜可以防止食品腐坏,保持食品的营养和味道.食品保鲜的措施有添加防腐剂、填充气体、放置干燥剂和脱氧保鲜剂等.
食品保鲜可以防止食品腐坏,保持食品的营养和味道.食品保鲜的措施有添加防腐剂、填充气体、放置干燥剂和脱氧保鲜剂等.