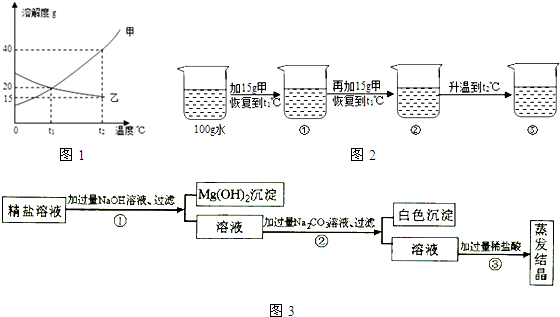
题目内容
某粗盐提纯后得到的“精盐”中还含有少量可溶性杂质CaCl2、MgCl2。小青同学设计了以下实验方案来除去可溶性杂质。

(1)步骤①的化学方程式为 。
(2)步骤②中得到的白色沉淀是 (填化学式)。
(3)步骤③中加稀盐酸是为了除去溶液中的 。
A.CaCl2 B.MgCl2 C.NaOH D.Na2C03
【答案】
(1)2NaOH+MgCl2== 2NaCl+Mg(OH)2↓
(2) CaCO3
(3) C、D
【解析】
试题分析:(1)在步骤①加入的氢氧化钠能与粗盐中的氯化镁反应,生成了氢氧化镁沉淀和氯化钠,反应的方程式是:MgCl2+2NaOH=2NaCl+Mg(OH)2↓;
(2)步骤②中加入的碳酸钠能与氯化钙反应生成了CaCO3沉淀和氯化钠;
(3)由于溶液中存在过量的氢氧化钠、碳酸钠.所以,骤③中加稀盐酸是为了除去溶液中的过量的碳酸钠和氢氧化钠。
考点:粗盐的提纯
点评:本题考查综合,既考查了粗盐提纯实验的有关注意事项,又考查了如何除去粗盐中的可溶性杂质的问题,解答时要依据相关知识细心分析。

练习册系列答案
相关题目