题目内容
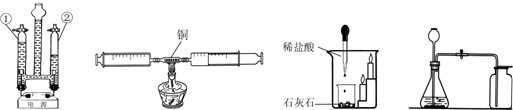
13.实验室用下列装置制取几种气体:按要求回答下列问题
(1)写出图中标有①、②的仪器名称酒精灯、量筒.
(2)某同学选用B和D两种装置,则他是否能制取并测量氧气的体积?是(填“是”或“否”).
(3)实验室用A和C装置可制取氧气,请写出氯酸钾与二氧化锰混合加热制氧气的文字表达式氯酸钾$→_{加热}^{二氧化锰}$氯化钾+氧气;在反应中二氧化锰所起的作用叫做催化作用;用C装置收集氧气时,检验氧气是否收集满的方法是将带火星的木条放在及集气瓶口,若复燃,则证明已满.
(4)若用E装置排空气收集氧气,则从b(填a或 b)管进气;用E装置除去氧气中混有的少量二氧化碳气体E中盛氢氧化钠溶液.
(5)常温下,乙炔是一种无色气体,密度比空气略小,难溶于水.实验室用电石(固体)与水反应制取乙炔. 你认为制取乙炔应选择的发生装置是B;收集装置是E.
分析 (1)熟悉常见仪器,了解名称;
(2)制取氢气为固体和液体的反应,无需加热,所以B装置可以.量取气体的体积的常用方法是排水法,根据水的体积和气体的体积相等,则用量筒量取的水的体积就是气体的体积.
(3)根据反应物、反应条件和生成物很容易写出反应的文字表达式.根据氧气支持燃烧的性质解答;
(4)根据氧气的密度比空气的大,为二氧化碳和氢氧化钠溶液反应解答;
(5)根据药品的状态和反应所需的条件选择发生装置;根据气体的性质如溶解性,密度,是否与空气中的成分或水发生反应来确定收集装置.
解答 解:
(1)图中①为酒精灯,②为量筒.故答案为:酒精灯、量筒;
(2)B和D装置相连.B装置中,试管中加锌片和稀盐酸就可以制的氢气,而D装置中集气瓶中装满水,则制得的氢气进入集气瓶,气体压力将水压入量筒,则气体的体积就是量筒中的水的体积,所以这个装置既可以制得氢气又可以测量氢气的体积.
(3)根据反应物是氯酸钾,二氧化锰是催化剂,生成物是氯化钾和氧气,文字表达式为:氯酸钾$→_{加热}^{二氧化锰}$氯化钾+氧气;在反应中二氧化锰所起的作用叫做催化作用;用C装置收集氧气时,检验氧气是否收集满的方法是将带火星的木条放在及集气瓶口,若复燃,则证明已满;
(4)氧气的密度比空气的大,若用E装置排空气收集氧气,则从b进;除去氧气中混有的少量二氧化碳,因为二氧化碳和氢氧化钠溶液反应而氧气不会和氢氧化钠溶液反应,因此可在洗气瓶内放入一定量氢氧化钠溶液;
(5)制乙炔是固体和液体在常温下反应,可用B做发生装置,乙炔难溶解于水,不和水反应,不和空气中的成分反应,密度比空气小,可用EF做收集装置;但排水法收集的气体较纯,故最佳的收集装置是E.
答案:
(1)酒精灯、量筒;
(2)是;
(3)氯酸钾$→_{加热}^{二氧化锰}$氯化钾+氧气;催化作用;将带火星的木条放在及集气瓶口,若复燃,则证明已满;
(4)b;氢氧化钠溶液;
(5)B;E.
点评 化学是一门以实验为基础的学科,因此实验仪器的使用,装置的选择,实验原理,注意事项,都是中考热点.

| A. | 甲、乙、丙 | B. | 丙、乙、甲 | C. | 丙、甲、乙、丙 | D. | 丙、甲、丙、乙 |
 碳酸钙可用于预防和治疗钙缺乏症.某实验小组同学要测定一种钙片中碳酸钙的含量.
碳酸钙可用于预防和治疗钙缺乏症.某实验小组同学要测定一种钙片中碳酸钙的含量.查阅资料:获得的资料有:
(1)补钙剂中常加入糖类、维生素D等改善口感或增强药效.这些物质不与稀盐酸反应产生气体,高温灼烧时会燃烧或分解.
(2)碳酸钙高温灼烧分解生成氧化钙和二氧化碳.
(3)常见的碳酸钙含量测定方法:将碳酸钙粉碎,加入已知浓度的过量盐酸充分反应,然后测剩余盐酸的量,根据消耗盐酸的量最终求得碳酸钙的含量.
(4)澄清石灰水中的Ca(OH)2含量很少,100g澄清石灰水中最多含0.15gCa(OH)2.
【方案设计和实施】根据资料和已学知识,该小组同学设计如下两种方案进行测定.
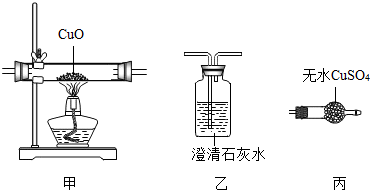
方案1:根据如图所示装置实验.
(1)锥形瓶中发生反应的化学方程式为CaCO3+2HCl═CaCl2+H2O+CO2↑.
(2)长颈漏斗下部插入液面下的目的是防止CO2气体逸出(液封).
(3)加入药品前,检验该装置气密性的方法是夹住胶管(堵住导管出口),从长颈漏斗加水至长颈漏斗中液面高于锥形瓶内液面,若一段时间不下降,则证明该装置气密性良好;
分析和评价.
(4)记录数据如下:
| 钙片质量 | 空洗气瓶质量 | 澄清石灰水的质量 | 反应后洗气瓶及瓶内物质总质量 |
| 25g | 100g | 200g | 300.4g |
| 加入稀盐酸的质量 | 100g | 200g | 300g | 400g |
| 充分反应后烧杯及杯内物质总质量 | 222.8g | 320.6g | 418.4g | 518.4g |
(1)方案1和方案2中合理的是方案2,原因是澄清石灰水中的Ca(OH)2含量很少(不足),吸收的二氧化碳量很少.
(2)该小组同学没有使用碳酸钙高温灼烧分解的方法(假设实验室可以进行该实验),原因是加入的糖类、维生素D等物质高温灼烧时会燃烧或分解,导致最终的数据偏大.
(3)要使用查阅资料(3)中介绍的方法,还需要学习的是如何测定未知浓度(剩余)盐酸的量.
【结论】经过计算,该钙片中碳酸钙的质量分数是60%.