题目内容
8.水垢主要成分是碳酸钙,某化学兴趣小组的同学欲测定某水垢中碳酸钙的质量分数,进行实验:将水垢洗净、干燥并搞碎后,称取10g放在烧杯里,然后加入45g稀盐酸充分反应至不再有气泡产生时,称得烧杯中剩余物为52.8g.(假设其他物质不与盐酸反应产生气体)(1)将水垢搞碎的目的是加快反应的速率.
(2)计算该水垢中碳酸钙的质量分数.
分析 (1)根据影响反应速率的因素进行分析;
(2)根据质量守恒定律计算生成二氧化碳的质量,然后依据化学方程式进行计算.
解答 解:(1)增大反应物的接触面积可以加快反应的速率,所以将水垢捣碎的目的是:加快反应的速率;
(2)生成二氧化碳的质量为:10g+45g-52.8g═2.2g,
设该水垢中碳酸钙的质量分数为x
CaCO3+2HCl═CaCl2+CO2↑+H2O
100 44
10g×x 2.2g
$\frac{100}{10g×x}$=$\frac{44}{2.2g}$
x=50%
故答案为:(1)加快反应的速率;
(2)50%.
点评 本题主要考查质量守恒定律和含杂质物质的化学方程式计算,难度不大,注意解题的规范性和准确性.

练习册系列答案
 小学期末冲刺100分系列答案
小学期末冲刺100分系列答案 期末复习检测系列答案
期末复习检测系列答案 超能学典单元期中期末专题冲刺100分系列答案
超能学典单元期中期末专题冲刺100分系列答案 黄冈360度定制密卷系列答案
黄冈360度定制密卷系列答案
相关题目
19.下列关于Na与Na+的认识,正确的是( )
| A. | 它们的质子数相同 | B. | 它们的电子层数相同 | ||
| C. | 它们的化学性质相同 | D. | Na比Na+多1个电子 |
3.物质的性质决定物质的用途.下列物质的用途中,利用其化学性质的是( )
①一氧化碳用作燃料
②氢气用于填充探空气球
③金刚石用于钻探机的钻头
④干冰用于致冷剂
⑤石墨用于制作电极
⑥氧气用于气焊.
①一氧化碳用作燃料
②氢气用于填充探空气球
③金刚石用于钻探机的钻头
④干冰用于致冷剂
⑤石墨用于制作电极
⑥氧气用于气焊.
| A. | ①⑥ | B. | ③⑤⑥ | C. | ③④⑤ | D. | ①②⑤ |
13.某同学为了探究“一混合气体的组成”,它可能由H2、CH4、CO中的一种或多种组成.于是他进行了以下实验:①点燃气体,在火焰上方罩一个冷而干燥的烧杯,内壁有水珠;②把烧杯倒过来,注入少量澄清的石灰水,振荡,石灰水变浑浊.于是他得出以下结论,你认为正确的是( )
| A. | 一定由H2、CH4组成 | B. | 一定由CO、CH4组成 | ||
| C. | 一定由H2、CH4、CO组成 | D. | 可能只含CH4 |
17.单层石黑称为石黑烯,是一种“只有一个碳原子厚的碳薄片”构成的新型材料,下列关于石黑稀的叙述中正确的是( )
| A. | 石墨烯不具有导电性 | B. | 石墨烯化学式为C | ||
| C. | 石墨烯中碳元素化合价为+4 | D. | 石墨烯属于化合物 |


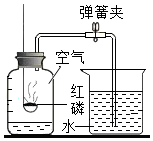 空气中氧气含量的测定
空气中氧气含量的测定