题目内容
14.在密闭容器内有四种物质,在一定条件下充分反应,测得反应前后各物质的质量如表:| 物质 | X | Y | Z | Q |
| 反应前质量/g | 8 | 2 | 20 | 5 |
| 反应后质量/g | 待测 | 2 | 8 | 20 |
A.反应后X的质量为6g
B.该反应属于分解反应
C.Y一定是催化剂
D.参加反应的X、Z的质量比是1:4.
分析 依据反应物的质量减小、生成物的质量变大、催化剂的质量不变判断反应物生成物及催化剂,利用反应前后物质的质量不变计算待测物质的质量,根据反应时物质的质量关系求出参加反应的物质的质量比.
解答 解:A、反应后X的质量为:8g+20g+5g-8g-20g=5g,错误;
B、X、Z的质量减少,属于反应物,Q的质量增加,属于生成物,Y的质量不变,可能是催化加,也可能没参加反应,多变一,化合反应,错误;
C、Y的质量不变,可能是催化加,也可能没参加反应,错误;
D、参加反应的X、Z的质量比是:3:12=1:4.
故选D.
点评 化学反应遵循质量守恒定律,即化学反应前后,元素的种类不变,原子的种类、总个数不变,这是书写化学方程式、判断物质的化学式、判断化学计量数、进行相关方面计算的基础.

练习册系列答案
相关题目
2.下列有关“2CO+O2$\frac{\underline{\;点燃\;}}{\;}$2CO2”的质量关系,不正确的是( )
| A. | 若56 g CO参加反应,则消耗O2的质量一定是32 g | |
| B. | 若16 g O2参加反应,则生成CO2的质量一定是44 g | |
| C. | 若10 g CO2生成,则消耗CO和O2的质量总和一定是10 g | |
| D. | 若5 g CO与2 g O2混合点燃,则生成CO2的质量一定是7 g |
9.小明在观察KNO3 和NaCl 的溶解度曲线(如图)后,得出了如下信息,其中存在错误的是( )


| A. | 温度高于t2℃时,KNO3的溶解度大于NaCl 的溶解度 | |
| B. | t1℃时,100g水最多能溶解20g KNO3 | |
| C. | t2℃时,KNO3的溶液和NaCl的溶液中溶质的质量分数相等 | |
| D. | NaCl 的溶解度受温度的影响小,KNO3的溶解度受温度的影响大 |
6.下列物质的用途主要是化学性质决定的是( )
| A. | 用铜线制作电线 | B. | 沼气燃烧 | ||
| C. | 开水沸腾 | D. | 发烧时病人用酒精降温 |
4.分别将NaCl、NH4NO3、NaOH、浓H2SO4溶于水中,温度明显降低的是( )
| A. | NaCl | B. | NH4NO3 | C. | NaOH | D. | 浓H2SO4 |

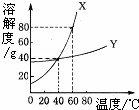 X、Y两种固体物质的溶解度曲线如图所示.回答下列问题:
X、Y两种固体物质的溶解度曲线如图所示.回答下列问题: 在现代生活中,人们越来越注重微量元素的摄取.碘元素对人体有着至关重要的作用.如图是某地市场销售的一种“加碘食盐”包装袋上的部分说明.
在现代生活中,人们越来越注重微量元素的摄取.碘元素对人体有着至关重要的作用.如图是某地市场销售的一种“加碘食盐”包装袋上的部分说明.