题目内容
现有菱铁矿(主要成分是FeCO3)60g,研碎后与足量盐酸充分反应,可得到标准状况下的二氧化碳11.2L(标准状况下二氧化碳的密度为1.97g/L),求该菱铁矿石中FeCO3的质量分数?分析:根据二氧化碳的体积和密度可求出二氧化碳的质量,根据生成的二氧化碳的质量和化学方程式可求出反应物菱铁矿中碳酸亚铁的质量分数;
解答:解:生成的质量11.2L×1.97g/L=22.1g
设该菱铁矿中FeCO3的质量分数为x%
FeCO3+2HCl=FeCl2+CO2↑+H2O
116 44
60g×x% 22.1g
=
x%=97.1%
答:该菱铁矿中FeCO3的质量分数为97.1%.
故答案为:97.1%
设该菱铁矿中FeCO3的质量分数为x%
FeCO3+2HCl=FeCl2+CO2↑+H2O
116 44
60g×x% 22.1g
| 116 |
| 60g×x% |
| 44 |
| 22.1g |
x%=97.1%
答:该菱铁矿中FeCO3的质量分数为97.1%.
故答案为:97.1%
点评:本题是有关化学方程式的计算和质量分数的计算有一点难度,需同学们认真、细心.

练习册系列答案
相关题目
现有菱铁矿(主要成分是FeCO3)60g,研碎后与足量盐酸充分反应,可得到标准状况下的二氧化碳11.2L(标准状况下二氧化碳的密度为1.97g/L),求该菱铁矿石中FeCO3的质量分数?______.
现有菱铁矿(主要成分是FeCO3)60g,研碎后与足量盐酸充分反应,可得到标准状况下的二氧化碳11.2L(标准状况下二氧化碳的密度为1.97g/L),求该菱铁矿石中FeCO3的质量分数?______.
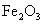 )60g,研碎后与足量盐酸充分反应,可得到标准状况下的二氧化碳11.2L(标准状况下二氧化碳的密度为1.97g/L),求该菱铁矿石中
)60g,研碎后与足量盐酸充分反应,可得到标准状况下的二氧化碳11.2L(标准状况下二氧化碳的密度为1.97g/L),求该菱铁矿石中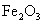 的质量分数?
的质量分数?