题目内容
16.请用化学用语填空:(1)据《南方都市报》报道,东莞虎门有人仅用锌条和硫酸,就从电镀废水(含有AgNO3等物质)中提炼出了金、银等贵重金属,请你凭此推断提炼的过程,用化学方程式表示:Zn+2AgNO3═Zn(NO3)2+2Ag.
(2)石灰石(主要成分CaCO3)、生石灰、熟石灰大量用作建筑材料,也是许多工业的重要原料.写出石灰石转化为纯度比较高的CaCO3的化学方程式CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2、CaO+H2O═Ca(OH)2、CO2+Ca(OH)2═CaCO3↓+H2O.
(3)工业上常用铝土矿(主要成分是氧化铝)电解来炼铝,化学方程式为2Al2O3$\frac{\underline{\;通电\;}}{\;}$4Al+3O2↑,用51t含氧化铝80%的铝土矿,理论上可以炼出金属铝21.6t.
(4)活性炭是防毒面具滤毒罐里的吸附剂,可用来吸附氯气等有毒气体,活性炭是一种混合物(填混合物或纯净物),下表列出了一定温度和压强下每立方厘米活性炭所能吸附的常见气体的体积:
| 气 体 | 二氧化碳 | 氢气 | 氧气 | 氮气 | 氯气 |
| 相对分子质量 | 44 | 2 | 32 | 28 | 71 |
| 沸 点/℃ | -78 | -252 | -183 | -196 | -34 |
| 被吸附体积/mL | 97 | 4.5 | 35 | 11 | 494 |
分析 (1)根据金属活动性顺序表的应用分析分析回答;
(2)根据石灰石、生石灰、熟石灰之间的转化进行分析解答即可.
(3)根据电解氧化铝来炼铝的方程式和氧化铝的质量计算;
(4)根据表中数据分析吸附的体积与气体的密度沸点之间的关系等.
解答 解:(1)由于锌的活动性大于银,能将银从其盐溶液中置换出来,反应的方程式是:Zn+2AgNO3═Zn(NO3)2+2Ag;
(2)石灰石的主要成分碳酸钙在高温下分解生成氧化钙和二氧化碳,反应的化学方程式为:CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑;生石灰与水反应生成氢氧化钙,反应的化学方程式为:CaO+H2O═Ca(OH)2;氢氧化钙与二氧化碳反应生成碳酸钙沉淀和水,反应的化学方程式为:CO2+Ca(OH)2═CaCO3↓+H2O.
(3)电解氧化铝得到了铝,反应的方程式是:2Al2O3$\frac{\underline{\;通电\;}}{\;}$4Al+3O2↑;
设得到铝的质量为x
2Al2O3$\frac{\underline{\;通电\;}}{\;}$4Al+3O2↑;
204 108
51t×80% x
$\frac{204}{108}=\frac{51t×80%}{x}$ 解得x=21.6t
(4)由表中数据可知,氯气的相对分子质量最大,最容易被活性炭吸附,氯气的沸点最高,最容易被活性炭吸附.活性炭容易吸附沸点高、相对分子质量大的气体.所以,活性炭吸附气体的一个规律是:在相同条件下,气体的沸点越高,越易被活性炭吸附,气体的相对分子质量越大,越易被活性炭吸附.
故答为:(1)Zn+2AgNO3═Zn(NO3)2+2Ag;(2)CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2,CaO+H2O═Ca(OH)2,CO2+Ca(OH)2═CaCO3↓+H2O.
(3)2Al2O3$\frac{\underline{\;通电\;}}{\;}$4Al+3O2↑,21.6;(4)混合物;在相同条件下,气体的沸点越高,越易被活性炭吸附,气体的相对分子质量越大,越易被活性炭吸附.
点评 本题主要考查了化学方程式的书写,化学方程式是重要的化学用语,是学习化学的工具,应加强学习.

【提出问题】滤液中除水外还含有那些物质?
【查阅资料】碳酸钾溶液显碱性
【猜想】A.可能含有氢氧化钾、氯化钾和碳酸钾
B.可能含有氢氧化钾、氯化钾
C.可能含有氢氧化钾、氯化钾、碳酸钾和氯化钙
你认为还可能是氢氧化钾、氯化钾和氯化钙(写出一种猜想)
【讨论】你认为C猜想不合理(填字母),请说明理由氯化钙和碳酸钾反应生成氯化钾和碳酸钙沉淀.
【实验设计】设计一个简单的实验,证明你的猜想正确.
| 实验步骤 | 实验现象 | 实验结论 |
| 取样于试管中,滴加适量的碳酸钾溶液. | 出现白色沉淀. | 猜想正确 |
| A. | 可证明水由氢、氧元素组成 | |
| B. | 水分子可以再分,而氢原子和氧原子不能再分 | |
| C. | 正、负极产生的气体质量比是1:2 | |
| D. | 在水中加少量氢氧化钠可增强水的导电性 |


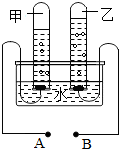 如图是电解水的实验装置图,请根据你所了解的知识填空:
如图是电解水的实验装置图,请根据你所了解的知识填空: