题目内容
20.钢铁是使用最多的金属材料,钢铁中碳的含量(质量分数)直接影响钢铁的性能.为测定钢铁中碳的质量分数,设计了如下实验,请根据下面的实验过程和提供的数据计算: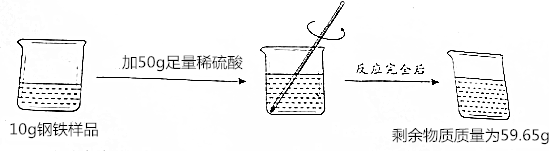
(1)反应后生成氢气的质量为0.35g.
(2)钢铁样品中碳的质量分数.
(3)反应后溶液中生成物的质量分数.
分析 铁与稀硫酸反应生成硫酸亚铁溶液和氢气;根据质量守恒定律,烧杯内质量的减少的质量即生成的氢气质量,据此根据反应的化学方程式列式计算出参加反应铁的质量、生成硫酸亚铁的质量,进而计算出钢铁样品中碳的质量分数、反应后溶液中生成物的质量分数.
解答 解:(1)由质量守恒定律,反应后生成氢气的质量为10g+50g-59.65g=0.35g.
(2)设参加反应铁的质量为x,生成硫酸亚铁的质量为y
Fe+H2SO4═FeSO4+H2↑
56 152 2
x y 0.35g
$\frac{56}{2}=\frac{x}{0.35g}$ x=9.8g
钢铁样品中碳的质量分数为$\frac{10g-9.8g}{10g}$×100%=2%.
(3)$\frac{152}{2}=\frac{y}{0.35g}$ y=26.6g
反应后溶液中生成物的质量分数为$\frac{26.6g}{9.8g+50g-0.35g}×$100%≈44.7%.
答:(1)0.35g;(2)钢铁样品中碳的质量分数为2%;(3)反应后溶液中生成物的质量分数为44.7%.
点评 本题难度不大,掌握利用化学方程式与溶质质量分数的综合计算即可正确解答本题,根据质量守恒定律计算出氢气的质量是正确解答本题的前提和关键.

练习册系列答案
 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案
相关题目
5.某品牌饮用水标签上标明了该水中钠、钾、钙等的含量.这里的钠、钾、钙等指的是( )
| A. | 原子 | B. | 元素 | C. | 分子 | D. | 单质 |
12.下列选用的除杂试剂和实验操作都正确的是(括号内为杂质)( )
| 选项 | 物质 | 除杂试剂 | 操作方法 |
| A | CaO(CaCO3) | / | 高温煅烧 |
| B | CO2(HCl) | 氢氧化钠溶液 | 气体通过盛有氢氧化钠溶液的洗气瓶 |
| C | KCl(KClO3) | MnO2 | 加入MnO2后加热 |
| D | Cu(CuO) | 氧气 | 通入足量氧气并加热 |
| A. | A、 | B. | B、 | C. | C、 | D. | D、 |
10.运用图示法可以帮助我们巧学化学.下列用数轴表示的化学知识不正确的是( )
| A. | 化合物中氮元素的化合价从低到高: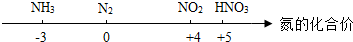 | |
| B. | 金属熔点从低到高: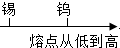 | |
| C. | 物质的相对分子质量从小到大: | |
| D. | 地壳中元素的含量从高到低: |
 碳元素是组成物质种类最多的一种元素,许多含碳物质都与我们的生活息息相关.
碳元素是组成物质种类最多的一种元素,许多含碳物质都与我们的生活息息相关.