题目内容
6.人类常从矿石中获取金属材料.(1)铁是冶炼最多的金属.工业炼铁主要反应的化学方程式是:Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2,反应中的氧化剂是Fe2O3.该反应中所涉及的物质中,属于单质的是Fe.常用于灭火的是CO2.
(2)铜是人类利用较早的金属,木炭与氧化铜反应生成二氧化碳的化学方程式是2CuO+C$\frac{\underline{\;高温\;}}{\;}$2Cu+CO2↑,反应后固体的质量减小(填“增大”、“减小”或“不变”)
(3)铝在现代生活中得到广泛的应用.炼铝原料水铝石的主要成分是Al(OH)3,Al(OH)3由三种元素组成,78克Al(OH)3中含有48g氧元素.
分析 (1)根据元素化合价的变化判断氧化剂和还原剂,一种元素组成的纯净物是单质,二氧化碳不能燃烧、且不支持燃烧、密度比空气大,可用于灭火;
(2)据木炭还原氧化铜的反应原理书写方程式,反应生成二氧化碳,所以固体的质量减小;
(3)根据Al(OH)3的化学式分析其元素组成种类,并据化学式进行计算.
解答 解:(1)Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2,反应中Fe元素的化合价降低,则Fe2O3被还原,为氧化剂;铁只有一种元素组成,是单质;二氧化碳不能燃烧、且不支持燃烧、密度比空气大,可用于灭火;
(2)木炭在高温条件下和氧化铜反应原理生成铜和二氧化碳,方程式是2CuO+C$\frac{\underline{\;高温\;}}{\;}$2Cu+CO2↑,反应生成二氧化碳,所以固体的质量减小;
(3)由Al(OH)3的化学式可知该物质由3种元素组成,78克Al(OH)3中含有氧元素的质量为:78g×$\frac{16×3}{27+16×3+1×3}×100%$=48g.
故答案为:(1)Fe2O3;Fe;CO2;(2)2CuO+C$\frac{\underline{\;高温\;}}{\;}$2Cu+CO2↑;减小;(3)三;48.
点评 能据元素化合价的升降判断氧化剂和还原剂,并掌握物质的性质,了解物质的组成等知识,考查 了学生掌握和应用知识的能力.

练习册系列答案
相关题目
14.下列是某同学所写的有关化学反应的文字表达式:下列判断正确的是( )
①硫十氧气$\stackrel{燃烧}{→}$二氧化硫 ②碳十氧气$\stackrel{点燃}{→}$二氧化碳
③镁十氧气$\stackrel{点燃}{→}$二氧化镁④钙十氧气$\stackrel{点燃}{→}$氧化钙
⑤铁十氧气$\stackrel{点燃}{→}$四氧化三铁 ⑥磷十氧气$\stackrel{点燃}{→}$五氧化二磷
⑦氯酸钾$\stackrel{二氧化锰}{→}$氯化钾十氧气 ⑧高锰酸钾$\stackrel{二氧化锰}{→}$锰酸钾十氧气.
①硫十氧气$\stackrel{燃烧}{→}$二氧化硫 ②碳十氧气$\stackrel{点燃}{→}$二氧化碳
③镁十氧气$\stackrel{点燃}{→}$二氧化镁④钙十氧气$\stackrel{点燃}{→}$氧化钙
⑤铁十氧气$\stackrel{点燃}{→}$四氧化三铁 ⑥磷十氧气$\stackrel{点燃}{→}$五氧化二磷
⑦氯酸钾$\stackrel{二氧化锰}{→}$氯化钾十氧气 ⑧高锰酸钾$\stackrel{二氧化锰}{→}$锰酸钾十氧气.
| A. | ②④⑤⑥⑦对,①③⑧错 | B. | ②④⑤⑥对,①③⑦⑧错 | C. | ②④⑤⑥⑧对,①③⑦错 | D. | ①③⑤⑦对,②④⑥⑧错 |
18.下列实验操作没有错误的是( )
| A. |  说明气密性良好 | B. |  稀释浓硫酸 | ||
| C. |  加热 | D. |  蒸馏水制备 |
15.在相同温度下,下列四种氯化钠溶液中溶质的质量分数最大的是( )
| A. | 20g NaC1溶于80g水中 | B. | 80g NaCl溶液中含氯化钠20g | ||
| C. | 18g水中溶解2g NaCl | D. | 该温度时,NaCl的饱和溶液 |
16.下列关于离子的叙述中,正确的是( )
| A. | 离子就是原子 | |
| B. | 离子跟原子一样,一般也是由质子、中子和电子构成 | |
| C. | 得到电子的原子显正电性 | |
| D. | 离子就是带电的原子,阳离子带负电 |
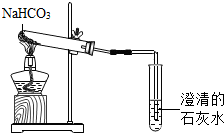 碳酸氢钠是一种重要的盐类物质,在生活中用途广泛.小红同学设计实验对碳酸氢钠的性质进行了探究.请你参与她的探究活动.
碳酸氢钠是一种重要的盐类物质,在生活中用途广泛.小红同学设计实验对碳酸氢钠的性质进行了探究.请你参与她的探究活动.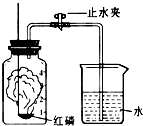 某化学兴趣小组的同学对空气中氧气含量的测定实验进行探究.
某化学兴趣小组的同学对空气中氧气含量的测定实验进行探究.